Nguyên tử - Đồng vị.Nguyên tử khối và nguyên tử khối trung bình
Cập nhật: 28/08/2020
Đồng vị :
Các nguyên tử của cùng một nguyên tố hoá học có thể có số khối khác nhau. Sở dĩ như vậy vì hạt nhân của các nguyên tử đó có cùng số proton nhưng có thể khác số nơtron.
Các đồng vị của cùng một nguyên tố hoá học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó số khối A của chúng khác nhau.
Các đồng vị được xếp vào cùng một vị trí (ô nguyên tố) trong bảng tuần hoàn.
Thí dụ: nguyên tố hiđro có ba đồng vị :
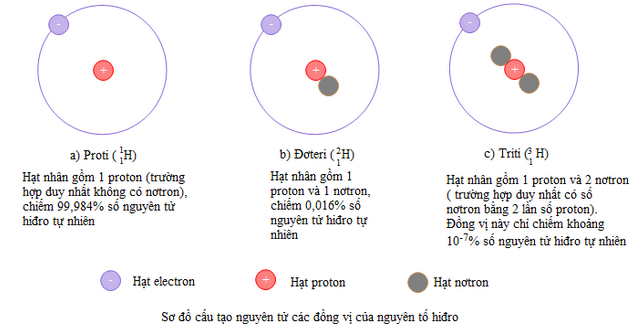
Phần lớn các nguyên tố hoá học là hỗn hợp của nhiều đồng vị. Ngoài khoảng 340 đồng vị tồn tại trong tự nhiên, người ta đã tổng hợp được 2400 đồng vị nhân tạo. Các đồng vị của cùng một nguyên tố hoá học có sô nơtron trong hạt nhân khác nhau, nên có một số tính chất vật lí khác nhau.
Thí dụ : Ở trạng thái đơn chất, đồng vị (35\17)Cl có tỉ số khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị (35\17)Cl
Người ta phân biệt các đồng vị bền và không bền. Hầu hết các đồng vị có số hiệu nguyên tử lớn hơn 83 (Z>83) là không bền, chúng còn được gọi là các đồng vị phóng xạ.
Nhiều đồng vị, đặc biệt là các đồng vị phóng xạ, được sử dụng nhiều trong đời sống, y học, nghiên cứu sự phát triển của cây trồng.....
Nguyên tử khối và nguyên tử khối trung bình :
+) Nguyên tử khối
Nguyên tử khối là khối lượng tương đối của nguyên tử
Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
Khối lượng của một nguyên tử bằng tổng khối lượng của proton, nơtron và electron trong nguyên tử đó. Proton và nơtron đều có khối lượng xấp xỉ 1u. Electron có khối lượng nhỏ hơn rất nhiều (0,00055u), nên có thể coi nguyên tử khối xấp xỉ số khối của hạt nhân
+) Nguyên tử khối trung bình
Hầu hết các nguyên tố hoá học là hỗn hợp của nhiều đồng vị với tỉ lệ phần trăm số nguyên tử xác định, nên nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử của mỗi đồng vị.
Giả sử nguyên tố có hai đồng vị A và B. Gọi (overline{A}) là nguyên tử khối trung bình, A là nguyên tử khối của đồng vị A, a là tỉ lệ phần trăm số nguyên tử của đồng vị A, B là nguyên tử khối của đồng vị B, b là tỉ lệ phần trăm số nguyên tử của đông vị B. Ta có :
(overline{A}) = (aA + bBover 100)
Trong những tính toán không cần độ chính xác cao, người ta coi nguyên tử khối bằng số khối
Thí dụ : Nguyên tố Clo có 2 đồng vị bền (35\17)Cl chiếm 75,77% và (35\17)Cl chiếm 24,23% . Nguyên tử khối trung bình của Clo là :
(overline{A_{Cl}}) = 35.(75,77over 100) + 37. (24,23over 100) ≈ 35,5
Nguồn: /

