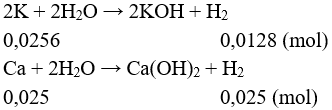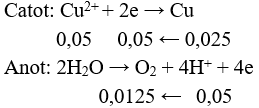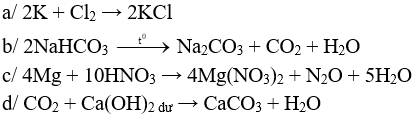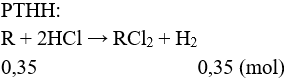Đề thi Giữa học kì 2, Môn: Hóa Học 12, Trắc nhiệm, Tự luận, (Đề 1)
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 1)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Cu = 64, Be = 9, Mg = 24, Ca = 40, Sr = 88, Ba = 137.
I. Phần trắc nghiệm
Câu 1: Chất phản ứng được với dung dịch NaOH tạo kết tủa là
A. KNO3.
B. FeCl3.
C. BaCl2.
D. K2SO4.
Câu 2: Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là
A. nhiệt phân CaCl2.
B. dùng Na khử Ca2+ trong dung dịch CaCl2.
C. điện phân dung dịch CaCl2.
D. điện phân CaCl2 nóng chảy.
Câu 3: Khi hòa tan hoàn toàn m gam mỗi kim loại vào nước dư, từ kim loại nào sau đây thu được thể tích khí H2 (cùng điều kiện nhiệt độ và áp suất) là nhỏ nhất?
A. Na.
B. Ca.
C. K.
D. Li.
Câu 4: Để bảo quản natri, người ta phải ngâm natri trong
A. nước.
B. rượu etylic.
C. dầu hỏa.
D. phenol lỏng.
Câu 5: Phát biểu nào sau đây là sai?
A. Các kim loại kiềm có nhiệt độ nóng chảy tăng dần từ Li đến Cs.
B. Các kim loại kiềm đều là kim loại nhẹ.
C. Các kim loại kiềm có bán kính nguyên tử lớn hơn so với các kim loại cùng chu kì.
D. Các kim loại kiềm có màu trắng bạc và có ánh kim.
Câu 6: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí và kết tủa trắng.
B. bọt khí bay ra.
C. kết tủa trắng xuất hiện.
D. kết tủa trắng, sau đó kết tủa tan dần.
Câu 7: Cho 1,2 gam một kim loại thuộc nhóm IIA trong bảng HTTH tác dụng với HCl thu được 0,672 lít khí (đktc). Kim loại đó là
A. Be.
B. Mg.
C. Ca.
D. Ba.
Câu 8: Điện phân 500 ml dung dịch CuSO4 0,1M (điện cực trơ) cho đến khi ở catot thu được 1,6 gam kim loại thì thể tích khí (đktc) thu được ở anot là
A. 2,24 lít.
B. 0,28 lít.
C. 0,56 lít.
D. 1,12 lít.
Câu 9: Nước cứng không gây ra tác hại nào dưới đây?
A. Gây ngộ độc nước uống.
B. Làm mất tính tẩy rửa của xà phòng, làm hư hại quần áo.
C. Làm hỏng các dung dịch pha chế. Làm thực phẩm lâu chín và giảm mùi vị thực phẩm.
D. Gây hao tốn nhiên liệu và không an toàn cho các nồi hơi, làm tắc các đường ống dẫn nước.
Câu 10: Cho 0,02 mol Na2CO3 tác dụng với lượng dư dung dịch HCl thì thể tích khí CO2 thoát ra (đktc) là
A. 0,672 lít.
B. 0,224 lít.
C. 0,336 lít.
D. 0,448 lít.
II. Phần tự luận
Câu 1 (2 điểm): Viết các PTHH xảy ra trong các trường hợp sau:
a/ K tác dụng với Cl2.
b/ Nhiệt phân NaHCO3.
c/ Mg tác dụng với HNO3 loãng (sp khử là N2O).
d/ CO2 tác dụng với Ca(OH)2 dư.
Câu 2 (2 điểm): Cho 11,6 (g) hỗn hợp M gồm 2 kim loại A, B thuộc 2 chu kì liên tiếp trong nhóm IIA của BTH vào dung dịch HCl dư thu được dung dịch X và 7,84 lít khí (ở đkc). Xác định hai kim loại A, B.
Câu 3 (2 điểm): Hấp thụ hoàn toàn 4,48 lít khí CO2 (ở đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra m gam kết tủa. Tính giá trị của m.
Câu 4 (1 điểm): Đốt cháy hoàn toàn 7,2 gam kim loại M (có hoá trị II không đổi trong hợp chất) trong hỗn hợp khí Cl2 và O2. Sau phản ứng thu được 23,0 gam chất rắn và thể tích hỗn hợp khí đã phản ứng là 5,6 lít (ở đktc). Xác định kim loại M.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | B | D | C | C | A | D | C | B | A | D |
Câu 1: FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl. Chọn đáp án B.
Câu 2: Phương pháp thích hợp điều chế kim loại Ca từ CaCl2 là điện phân CaCl2 nóng chảy. Chọn đáp án D.
Câu 3: So sánh nhóm I: Li, Na, K.Ta có MK lớn nhất → Vkhí thu được là nhỏ nhất.
Giả sử m = 1 gam.
Chọn đáp án C.
Câu 4: Để bảo quản natri, người ta phải ngâm natri trong dầu hỏa. Chọn đáp án C.
Câu 5: Phát biểu sai: Các kim loại kiềm có nhiệt độ nóng chảy tăng dần từ Li đến Cs. Chọn đáp án A.
Câu 6: CO2 + Ca(OH)2 → CaCO3 ↓ trắng + H2O
CaCO3 ↓ + CO2 dư + H2O → Ca(HCO3)2. Chọn đáp án D.
Câu 7: Bảo toàn e: nKL = nkhí = 0,03 mol → MKL = 1,2 : 0,03 = 40. Vậy KL là Ca. Chọn đáp án C.
Câu 8:
V = 0,0125.22,4 = 0,28 lít. Chọn đáp án B.
Câu 9: Nước cứng không gây ngộ độc nước uống. Chọn đáp án A.
Câu 10: Bảo toàn C: nCO2 = nNa2CO3 = 0,02 → V = 0,02.22,4 = 0,448 lít.
2. Phần tự luận
Câu 1 (2điểm): HS viết đúng mối PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PTHH.
Câu 2 (2điểm): Tính được nkhí = 0,35 mol.
Đặt 2 kim loại tương ứng với 1 kim loại là R.
Giả sử MA < MB → MA < MR < MB
MR = 11,6 : 0,35 = 33,14.
Vậy 2 kim loại là Mg (M = 24) và Ca (M = 40).
Câu 3 (2điểm): Tính được: nkhí = 0,2 mol, nOH- = 0,25 mol Đặt 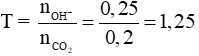
Giải hệ được x = 0,15 và y = 0,05.
Theo (3) → Ba2+ dư, m↓ = 0,05.197 = 9,85 gam.
Câu 4 (1điểm): Tính được nkhí = 0,25 mol
Bảo toàn khối lượng: mkhí = 23 – 7,2 = 15,8 gam
Gọi số mol Cl2, O2 lần lượt là x và y (mol)
nkhí = 0,25 mol → x + y = 0,25
mkhí = 15,8 gam → 71x + 32y = 15,8
Giải hệ được x = 0,2 và y = 0,05.
Bảo toàn e: 2.nM = 2.nCl2 + 4.nO2 → nM = 0,3 mol
MM = 7,2 : 0,3 = 24. Vậy M là Mg.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.