Đề thi thử THPT Quốc gia môn Hóa học Trường THPT Thăng Long - Hà Nội năm học 2019 - 2020 lần 2
Cập nhật: 29/08/2020
1.
Cho 0,448 lít khí NH3 (đktc) đi qua ống sứ đựng 16 gam CuO nung nóng, thu được chất rắn X (giả sử phản ứng xảy ra hoàn toàn). Phần trăm khối lượng của Cu trong X là
A:
12,37%.
B:
87,63%.
C:
14,12%.
D:
85,88%.
Đáp án: A
nNH3 = 0,02 mol nCuO = 0,2 mol
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Ban đầu: 0,2 0,02
Phản ứng: 0,03 ← 0,02 mol 0,03 mol nên : 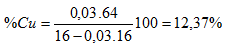
2.
Cho 13,44 lít khí clo (ở đktc) đi qua 2,5 lít dung dịch KOH ở 100oC. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là (cho Cl = 35,5; K = 39)
A:
0,24M
B:
0,48M
C:
0,4M
D:
0,2M
Đáp án: A
n Cl2 = (13,44over 22,4 )= 0,6 mol , n KCl = (37,25over 74,5) = 0,5 mol
3Cl2 + 6KOH đun nóng → KClO3 + 5KCl + 3H2O
Ban đầu 0,6 chưa biết
Phản ứng 0,3 0,6 0,5
Kết thúc 0,3 0 0,5
Theo phản ứng nKOH = 6/5. nKCl = 6.0,5/5 = 0,6 mol → CM KOH = ( n over V ) = (0,6over 2,5) = 0,24 M
=> Đáp án A
3.
Cho luồng khí H2 (dư) qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung ở nhiệt độ cao.
Sau phản ứng hỗn hợp rắn còn lại là:
A:
Cu, Fe, Zn, MgO.
B:
Cu, Fe, ZnO, MgO.
C:
Cu, Fe, Zn, Mg.
D:
Cu, FeO, ZnO, MgO.
Đáp án: A
K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Hg Ag Pt Au
H2 , CO , Al khử được oxit của kim loại từ Zn trở đi
CuO + H2 ( o)Cu + H2O
Fe2O3 + H2 ( o) Fe + H2O
ZnO + H2 ( o) Zn + H2
MgO không bị khử nên chất rắn sau phản ứng là : Cu , Fe , Zn , MgO
( o) Chọn A
4.
Đốt cháy hoàn toàn m gam hỗn hợp X gồm andehit benzoic ; axetandehit ; etandial ; andehit acrylic cần 0,975 mol O2 và thu được 0,9 mol CO2 và 0,65 mol H2O. Nếu cho m gam X tác dụng với lượng dư dung dịch AgNO3/NH3 thu được tối đa m1 gam Ag. Giá trị của m1 là :
A:
54g
B:
216g
C:
108g
D:
97,2g
Đáp án: C
Ta thấy nAg = 2nCHO = 2nO(X)
Bảo toàn nguyên tố O : nO(X) = 2nCO2 + nH2O – 2nO2 = 0,5 mol
=> mAg = 108g
Đáp án đúng C
5.
Chất A có công thức phân tử là C3H12N2O3. Chất B có công thức phân tử là CH4N2O. A,B lần lượt phản ứng với dung dịch HCl cũng cho ra một khí Z. Mặt khác khi cho A,B tác dụng với dung dịch NaOH thì A cho khí X còn B cho khí Y. Phát biểu nào sau đây đúng :
A:
X,Y,Z phản ứng được với dung dịch NaOH
B:
MZ > MY > MX
C:
X,Y làm quì tím hóa xanh
D:
Z vừa phản ứng được với NaOH vừa phản ứng được với HCl
Đáp án: C
Chất B là H2N – CO – NH2 phản ứng với NaOH tạo NH3 ( khí Y)
B + HCl tạo khí CO2(Z) => A + HCl cũng tạo khí CO2 => A là (CH3NH3)2CO3
=> X là CH3NH2
Đáp án đúng C
6.
Bảng dưới đây ghi lại hiện tượng khi làm thí nghiệm với các chất X, Y ,Z, T ở dạng dung dịch với dung môi nước:
|
Thuốc thử
Chất |
X |
Y |
Z |
T |
|
Dung dịch AgNO3/NH3 đun nhẹ |
Không có kết tủa |
Ag↓ |
Không có kết tủa |
Ag↓ |
|
Cu(OH)2, lắc nhẹ |
Cu(OH)2 không tan |
Dung dịch xanh lam |
Dung dịch xanh lam |
Dung dịch xanh lam |
|
Nước brom |
Mất màu nước brom và có kết tủa trắng xuất hiện |
Mất màu nước brom |
Không mất màu nước brom |
Không mất màu nước brom |
Các chất X, Y, Z, T lần lượt là
A:
Phenol, Axit fomic, saccarozo, glucozo
B:
Anilin, glucozo, glixerol, fructozo
C:
Anilin, mantozo, etanol, axit acrylic
D:
Phenol, glucozo, glixerol, mantozo
Đáp án: B
T không làm mất màu nước Brom => Dựa vào đáp án chỉ có fructozo thỏa mãn
Đáp án đúng B
7.
Thuốc thử để phân biệt axit axetic và ancol etyilc là
A:
Phenolphtalein
B:
Quỳ tím
C:
Nước brom
D:
AgNO3 trong dung dịch NH3
Đáp án: B
Axit làm đổi màu quỳ tìm còn ancol thì không
Đáp án đúng B
8.
Cho m gam hỗn hợp X gồm Fe, Fe 3O4 và Fe(NO3)2 tan hết trong 320 ml dung dịch KHSO4 1M. Sau phản ứng thu được dung dịch Y chỉ chứa 59,04 gam muối trung hòa và 0,896 lít NO (đktc, sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào Y thì có 0,44 mol NaOH phản ứng. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X gần giá trị nào nhất sau đây?
A:
3,5%.
B:
2,0%.
C:
3,0%.
D:
2,5%.
Đáp án: C
Bảo toàn khối lượng tìm m, trong Y có Fe2+, Fe3+, NO3-, SO42-
Đáp án đúng C
9.
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic (MX < MY); cho Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X, Y và Z. Đốt cháy hoàn toàn 11,16 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 13,216 lít khí O2 (đktc), thu được khí CO2 và 9,36 gam nước Mặt khác 11,16 gam E tác dụng tối đa với dung dịch chứa 0,04 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng với KOH dư là
A:
5,44 g
B:
5,04 g
C:
5,80 g
D:
4,68 g.
Đáp án: D
X, Y là các axit đơn và T là este 2 chức → Z là ancol 2 chức
TN1: BTKL: mCO2 = 11,16 + 0,59 . 32 - 9,36 = 20,68
→ CO2 : 0,47 mol < H2O : 0,52mol → Z là ancol no
Axit: CnH2n-2O2 (a mol) ; este : CmH2m-6O4 (b mol) ; ancol : CkH2k+2O2(c mol)
BT ngtố O: 2a + 4b + 2c = 0,28
TN2: BT mol LK pi: a + 2b = 0,04 → c = 0,1 mol
CO2-H2O = 0,05 → - a - 3b + 0,1 = 0,05
→ a = 0,02 ; b = 0,01
Số ngtử Ctb=3,6 . Z có cùng số nguyên tử cacbon với X(X có ít nhất 3C), T có số C nhiều hơn. Do đó ancol là C3H8O2
E + KOH → muối + ancol + H2O
a+2b b+c a(H2O do axit tạo ra)
BTKL : m = 4,68(g)
Đáp án đúng D
10.
Chính quyền Xô Viết Nghệ Tĩnh được thành lập bằng cách nào?
A:
Do dân bầu ra
B:
Ban chấp hành nông hội xã quản lý chính quyền dưới sự lãnh đạo của chi bộ Đảng
C:
Chi bộ Đảng ở địa phương đứng ra nắm lấy chính quyền
D:
Công nhân đứng ra nắm lấy chính quyền
Đáp án: B
11.
Đốt cháy hoàn toàn amin đơn chức X bằng O2, thu được 1,12 lít N2, 8,96 lít CO2 (các khí đo ở đktc) và 8,1 gam H2O. Công thức phân tử của X là
A:
C3H9N
B:
C4H11N
C:
C4H9N
D:
C3H7N
Đáp án: C
Số mol N chứa trong amin là: (1,12/22,4).2 = 0,1 (mol)
Số mol C chứa trong amin là: 8,96/22,4 = 0,4 (mol)
Số mol H chứa trong amin là: (8,1/18).2=0,9 (mol)
Ta có tỉ lệ:
C : H : N = 0,4 : 0,9 : 0,1 = 4 : 9 : 1
Vậy công thức amin là C4H9N
12.
Điện phân dung dịch chứa 0,2 mol FeCl3; 0,1 mol CuCl2 và 0,15 mol HCl (điện cực trơ, màng ngăn xốp) với dòng điện I = 1,34 A trong 12 giờ. Khi dừng điện phân khối lượng catot đã tăng:
A:
6,4 g
B:
11,2 g
C:
9,2 g
D:
7,8 g
Đáp án: D
Catot:
Fe3+ + 1e → Fe2+
Cu2+ + 2e → Cu
2H+ + 2e → H2
Fe2+ + 2e → Fe
ne trao đổi = 0,6 mol
⇒ Theo thứ tự trên thì sau phản ứng có: 0,1 mol Cu và 0,025 mol Fe
⇒ m tăng = 0,1 × 64 + 0,025 × 56 = 7,8 g
13.
Polivinyl axetat (hoặc poli (vinyl axetat) là polime được điều chế bằng phản ứng trùng hợp?
A:
CH2=CH-COO-C2H5
B:
C2H5COO-CH=CH2
C:
CH3COO-CH=CH2
D:
CH2=CH-COO-CH3
Đáp án: C
14.
Hòa tan hỗn hợp ba kim loại Zn, Fe, Cu bằng dung dịch HNO3 loãng. Sau khi phản ứng xảy ra hoàn toàn, thu được chất không tan là Cu. Phần dung dịch sau phản ứng chắc chắn có chứa:
A:
Zn(NO3)2; Fe(NO3)3.
B:
Zn(NO3)2; Fe(NO3)2.
C:
Zn(NO3)2; Fe(NO3)2; Cu(NO3)2.
D:
Zn(NO3)2; Fe(NO3)3; Cu(NO3)2.
Đáp án: B
Cu dư không có Fe(NO3)3 ⇒ loại A, D
Do Cu có thể chưa phản ứng nên muối của Cu có thể không có
15.
Đốt cháy hoàn toàn 2,24 gam Fe trong khí Cl2 dư, thu được m gam muối clorua. Giá trị của m là:
A:
3,25
B:
2,80
C:
5,08
D:
6,5
Đáp án: D
Đốt cháy trong Cl2 dư thu được muối FeCl3
Có n(FeCl_3) = nFe = 0,04 mol
⇒ m = 6,5 g
Nguồn: /

