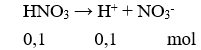Đề kiểm tra Giữa kì 1, Môn: Hóa Học lớp 11, (Đề 3)
Cập nhật: 14/12/2022
Đề kiểm tra Giữa kì 1
Môn: Hóa Học lớp 11
Thời gian làm bài: 45 phút
(Đề 3)
Cho biết: Al = 27; S = 32; O = 16; Cl = 35,5; H = 1, K = 39, Cu = 64; Fe = 56.
Phần I: Trắc nghiệm
Câu 1. Chất không phân li ra ion khi hòa tan trong nước là
A. CaCl2.
B. HClO.
C. Ca(OH)2.
D. C2H5OH.
Câu 2. Hợp chất thuộc loại chất điện li mạnh là
A. CH3COOCH3.
B. C2H5OH.
C. H2O.
D. KCl.
Câu 3. Muối nào sau đây là muối axit?
A. NH4Cl.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COONa.
Câu 4. Chất không có tính lưỡng tính là
A. K2SO4.
B. ZnO.
C. Al(OH)3.
D. NaHCO3.
Câu 5. Để phân biệt dung dịch NH4Cl và dung dịch CuCl2 ta dùng dung dịch
A. HCl.
B. H2SO4.
C. NaNO3.
D. NaOH.
Câu 6. Giả sử dung dịch các chất sau: HCl; Na2SO4, NaOH, KCl đều có nồng độ 0,01M. Dung dịch sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào là
A. HCl.
B. Na2SO4.
C. NaOH.
D. KCl.
Câu 7. Phương trình ion rút gọn của phản ứng cho biết
A. Những ion nào tồn tại trong dung dịch.
B. Nồng độ những ion nào trong dung dịch lớn nhất.
C. Bản chất của phản ứng trong dung dịch các chất điện li.
D. Không tồn tại phân tử trong dung dịch các chất điện li.
Câu 8. Một dung dịch có [OH-] = 0,5.10-10M. Môi trường của dung dịch là
A. axit.
B. kiềm.
C. trung tính.
D. không xác định.
Câu 9. Đối với dung dịch axit mạnh HNO3 0,10M, nếu bỏ qua sự điện li của nước thì đánh giá nào về nồng độ mol ion sau đây là đúng?
A. [H+] = 0,10M.
C. [H+] > [NO3-].
B. [H+] < [NO3-].
D. [H+] < 0,10M.
Câu 10. Trong dung dịch NH3 (bỏ qua sự phân li của H2O) có những phần tử nào?
A. H+, NH2-.
B. NH4+, OH-, H2O.
C. NH4+, OH-, NH3, H2O.
D. H+, OH-, NH3, H2O.
Câu 11. Dung dịch Ba(OH)2 có pH = 13 thì nồng độ của Ba(OH)2 là
A. 0,05M.
B. 0,1M.
C. 0,01M.
D. 0,005M.
Câu 12. Giả sử các dung dịch sau đều có cùng nồng độ mol, dung dịch có pH lớn nhất là
A. KOH.
B. Ba(OH)2.
C. NH3.
D. NaCl.
Câu 13. Chọn phát biểu không đúng khi nói về NaHCO3.
A. là muối axit.
B. dung dịch NaHCO3 có môi trường kiềm.
C. có tính lưỡng tính.
D. không tác dụng với dung dịch NaOH.
Câu 14. Cho K dư vào dung dịch chứa FeCl3. Hãy cho biết hiện tượng xảy ra?
A. Có khí bay lên.
B. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan hoàn toàn.
C. Có khí bay lên và có kết tủa trắng xuất hiện sau đó tan một phần.
D. Có khí bay lên và có kết nâu đỏ xuất hiện.
Câu 15. Các ion nào sau đây cùng tồn tại trong một dung dịch?
A. Na+, Mg2+, NO3-, CO32-.
B. Ba2+, Na+, Cl-, HCO3-.
C. Ag+, Fe2+, HCO32-, NO3- .
D. K+, Al3+, Cl-, OH-.
Câu 16: Phản ứng nào sau đây là phản ứng trao đổi ion trong dung dịch chất điện li?
A. BaO + CO2 → BaCO3.
B. Zn + CuCl2 → ZnCl2 + Cu.
C. Ba(NO3)2 + 2KOH → Ba(OH)2 + 2KNO3.
D. MgSO4 + Ca(OH)2 → Mg(OH)2 + CaSO4.
Phần II: Tự luận
Câu 1. (2 điểm) Viết phương trình điện li của các chất sau trong dung môi nước:
a. Ba(OH)2
b. CH3COOH
c. K2S
d. Zn(OH)2.
Câu 2. (2 điểm) Viết phương trình phân tử và phương trình ion thu gọn của các phản ứng sau:
a. Ba(OH)2 + HCl →
b. CaCO3 + HNO3 →
Câu 3. (4 điểm) Dung dịch A có chứa: 0,01 mol M2+ ; 0,02 mol Al3+; 0,03 mol HCO32- và x mol Cl-. Khi cô cạn dung dịch A thu được 4,77 gam chất rắn khan.
a. Xác định giá trị của x và nguyên tố M.
b. Cho 300 ml dung dịch KOH 0,3M vào dung dịch A thu được m gam các chất kết tủa và dung dịch B. Xác định giá trị của m.
c. Nếu cô cạn dung dịch B sẽ thu được bao nhiêu gam chất rắn khan?
Đáp án & Hướng dẫn giải
Phần I: Trắc nghiệm
Câu 1. C
C2H5OH không phân li ra ion khi hòa tan trong nước.
Câu 2. D
KCl là muối tan nên là chất điện li mạnh.
Câu 3. C
Muối axit là muối mà gốc axit vẫn còn hiđro có thể phân li ra ion H+.
Vậy Ca(HCO3)2 là muối axit do:
HCO3- ⇌ H+ + CO32-.
Câu 4. A
K2SO4 là muối trung hòa, không có tính lưỡng tính.
Câu 5. D
NH4+ + OH- → NH3↑ + H2O
Cu2+ + 2OH- → Cu(OH)2↓
Câu 6. C
Dung dịch NaOH có pH > 7 nên sẽ chuyển sang màu hồng khi nhỏ chất chỉ thị phenolphtalein vào.
Câu 7. C
Phương trình ion rút gọn của phản ứng cho biết bản chất của phản ứng trong dung dịch chất điện li.
Câu 8. A
[OH-] = 0,5.10-10M < 10-7 M → [H+] > 10-7 M
Vậy dung dịch có môi trường axit.
Câu 9. A
Câu 10. C
NH3 + H2O ⇌ NH4+ + OH
Câu 11. A
[H+] = 10-13 → [OH-] = 0,1 (M).
Nồng độ của Ba(OH)2 là 0,05 (M)
Câu 12. B
Dung dịch nào có [OH-] càng lớn thì pH càng lớn.
Câu 13. D
NaOH + NaHCO3 → Na2CO3 + H2O.
Câu 14. D
2K + 2H2O → 2KOH + H2↑
FeCl3 + 3KOH → Fe(OH)3 ↓ nâu đỏ + 3KCl.
Câu 15. B
A sai do Mg2+ + CO32- → MgCO3↓
C sai do Ag+ + Fe2+ → Ag + Fe3+
D sai do Al3+ + 3OH- → Al(OH)3↓
Câu 16. D
MgSO4 + Ca(OH)2 → Mg(OH)2↓ + CaSO4↓
A sai vì là phản ứng hóa hợp.
B sai vì là phản ứng thế.
C sai do không thỏa mãn điều kiện xảy ra phản ứng trao đổi.
Phần II: Tự luận
Câu 1.
a. Ba(OH)2 → Ba2+ + 2OH-
b. CH3COOH ⇌ CH3COO- + H+
c. K2S → 2K+ + S2-
d. Zn(OH)2 ⇌ Zn2+ + 2OH-
Zn(OH)2 ⇌ ZnO22- + 2H+.
Câu 2.
a. Ba(OH)2 + 2HCl → BaCl2 + 2H2O
PT ion rút gọn: H+ + OH- → H2O
b. CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 ↑ + H2O
PT ion rút gọn:
CaCO3 + 2H+ → Ca2+ + CO2 + H2O.
Câu 3.
a. Bảo toàn điện tích có: 0,01.2 + 0,02.3 = 0,03.2 + x
→ x = 0,02 (mol).
Bảo toàn khối lượng có:
mmuối = ∑mion → 0,01.MM + 0,02.27 + 0,03.96 + 0,02.35,5 = 4,77
→ MM = 64. Vậy kim loại M là Cu.
b. Cho KOH vào dung dịch A có các phản ứng:
Vậy kết tủa sau phản ứng gồm: Cu(OH)2: 0,01 mol và Al(OH)3: 0,01 mol
m = 0,01.98 + 0,01.78 = 1,76 gam.
c. Dung dịch B gồm:
SO42-: 0,03 mol; Cl-: 0,02 mol; AlO2-: 0,01 mol và K+: 0,09 mol.
Cô cạn dung dịch B được chất rắn có khối lượng:
m = 0,03.96 + 0,02.35,5 + 0,01.59 + 0,09.39 = 7,69 gam.
Nguồn: /
Tags : Đề kiểm tra Giữa kì 1 Hóa Học lớp 11 Đề 3