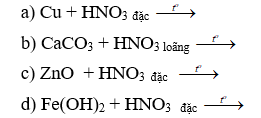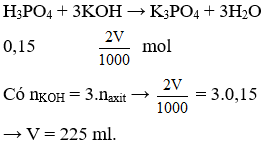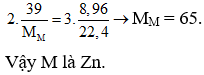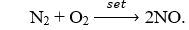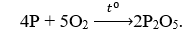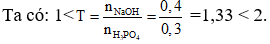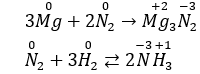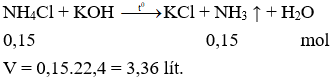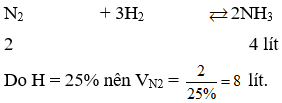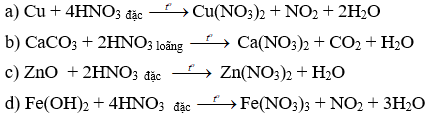Đề kiểm tra Giữa kì 1, Môn: Hóa Học lớp 11, (Đề 5)
Cập nhật: 14/12/2022
Đề thi Giữa kì 1
Môn: Hóa Học lớp 11
Thời gian làm bài: 45 phút
(Đề 5)
Phần I: Trắc nghiệm
Câu 1. Trung hòa 100ml dung dịch H3PO4 1,5M cần Vml dung dịch KOH 2M. Giá trị của V là
A. 75ml.
B. 300ml.
C. 225ml.
D. 150ml.
Câu 2. Cho phản ứng NH3 + HCl → NH4Cl. Vai trò của amoniac trong phản ứng trên?
A. Bazơ.
B. Axit.
C. Chất oxi hóa.
D. Chất khử.
Câu 3. Muối amoni là chất điện li thuộc loại nào?
A. Yếu.
B. Mạnh.
C. Không xác định được.
D. Trung bình.
Câu 4. Cho 39 gam kim loại M phản ứng hoàn toàn với dung dịch HNO3 thu được 8,96 lit khí NO (là sản phẩm khử duy nhất ở đktc). Kim loại M là
A. Zn.
B. Ca.
C. Cu.
D. Mg.
Câu 5. Sấm sét trong khí quyển có thể tạo ra chất khí nào trong các khí sau ?
A. N2.
B. NO.
C. N2O.
D. CO.
Câu 6. Sản phẩm khi cho photpho tác dụng với oxi dư là
A. P2O3.
B. P2O5.
C. P5O2.
D. PO5.
Câu 7. Cho 0,3 mol axit H3PO4 tác dụng với dd chứa 0,4 mol NaOH thì sau phản ứng thu được các muối nào?
A. NaH2PO4, NaOH dư.
B. Na2HPO4, Na3PO4.
C. NaH2PO4, Na2HPO4.
D. NaH2PO4, Na3PO4.
Câu 8. Phân bón nào sau đây có hàm lượng đạm cao nhất là
A. NH4NO3.
B. (NH4)2SO4.
C. Ca(NO3)2.
D. (NH2)2CO.
Câu 9. Nitơ đóng vai trò là chất oxi hóa trong phản ứng với
A. oxi và các chất oxi hóa khác.
B. hiđro và oxi.
C. kim loại và oxi.
D. kim loại và hiđro.
Câu 10. Đưa hai đầu đũa thủy tinh chứa NH3 đặc và HCl đặc lại gần nhau. Hiện tượng xảy ra là
A. không có hiện tượng.
B. có khói nâu.
C. có khí mùi khai bay lên.
D. có khói trắng.
Câu 11. Cho 9,6 gam Cu tác dụng hết với dd HNO3 loãng. Thể tích khí NO là sản phẩm khử duy nhất ở đktc thu được là
A. 3,36 lít.
B. 2,24 lít.
C. 4,48 lít.
D. 6,72 lít.
Câu 12. Khi dung dịch axit HNO3 đặc tác dụng với kim loại thì thông thường sẽ sinh khí nào sau đây?
A. NH3.
B. NO.
C. NO2.
D. N2O.
Câu 13. HNO3 đặc, nguội không tác dụng với
A. Fe, Al.
B. Cu, Ag.
C. Fe, Ag.
D. Hg, Al.
Câu 14. Cho dung dịch KOH dư vào 150ml dd NH4Cl 1M. Đun nhẹ thu được thể tích khí thoát ra ở (đktc) là
A. 2,24 lit.
B. 3,36 lit.
C. 1,12 lit.
D. 4.48 lit.
Câu 15. Nhiệt phân Cu(NO3)2 thu được các chất nào sau đây?
A. Cu, NO2, O2.
B. Cu2O, NO2, O2.
C. CuO, NO2, O2.
D. Cu(NO2)2, O2.
Câu 16. Để điều chế 4 lít NH3 từ N2 và H2 với hiệu suất 25% thì thể tích N2 cần dùng ở cùng điều kiện là:
A. 8 lít.
B. 16 lít.
C. 2 lít.
D. 4 lít.
Phần II: Tự luận
Câu 1: (2 điểm) Hoàn thiện sản phẩm và cân bằng các phương trình hoá học sau:
Câu 2: (2 điểm) Bằng phương pháp hoá học hãy nhận biết các dung dịch mất nhãn sau: NaNO3, HNO3, HCl.
Câu 3: ( 2 điểm) Cho 4,9 gam hỗn hợp Fe và Cu (trong đó Cu chiếm 60% khối lượng) vào một lượng dung dịch HNO3 khuấy đều đến phản ứng hoàn toàn thấy còn lại 2,3 gam chất rắn không tan. Xác định khối lượng muối tạo thành sau phản ứng.
Đáp án & Hướng dẫn giải
Phần I: Trắc nghiệm
Câu 1. C
Câu 2. A
Câu 3. B
Tất cả các muối amoni đều dễ tan trong nước và khi tan điện li hoàn toàn thành các ion.
Câu 4. A
Theo các đáp án xác định được số e nhường ở các trường hợp là bằng nhau và bằng 2. Áp dụng định luật bảo toàn electron có :
Câu 5. B
Câu 6. B
Câu 7. C
Vậy sau phản ứng thu được 2 muối: NaH2PO4, Na2HPO4.
Câu 8. D
Ure: (NH2)2CO có hàm lượng đạm cao nhất.
Câu 9. D
N2 đóng vai trò là chất oxi hóa khi tác dụng với kim loại và hiđro.
Vd:
Câu 10. D
NH3 + HCl → NH4Cl.
Câu 11. B
Bảo toàn electron:
2.nCu = 3.nNO → nNO = 0,1 mol
→ Vkhí = 0,1.22,4 = 2,24 lít.
Câu 12. C
Câu 13. A
Al, Fe bị thụ động hóa trong HNO3 đặc, nguội.
Câu 14. B
Câu 15. C
Câu 16. A
Phần II: Tự luận
Câu 1.
Câu 2.
Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho vào mỗi ống nghiệm một mẩu quỳ tím
+ Quỳ tím không đổi màu → NaNO3.
+ Quỳ tím chuyển sang màu đỏ → HNO3, HCl (nhóm I).
- Phân biệt nhóm I dùng AgNO3
+ Không hiện tượng → HNO3
+ Có kết tủa trắng → HCl
AgNO3 + HCl → AgCl (↓ trắng ) + HNO3
Câu 3.
Theo bài ra ta có:
mCu = 2,94 gam , mFe = 1,96 gam, nFe = 0,035 mol; nCu = 0,046 mol.
→ Sau phản ứng còn 2,3 gam < mCu = 2,94 gam → chất rắn không tan là Cu, dung dịch sau phản ứng chứa Cu(NO3)2 và Fe(NO3)2.
Có nFe(NO3)2 = nFe = 0,035 mol;
nCu(NO3)2 = nCu pư = 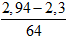
→ mmuối = mFe(NO3)2 + mCu(NO3)2 = 0,035.180 + 0,01. 188 = 8,18 gam.
Nguồn: /
Tags : Đề kiểm tra Giữa kì 1 Hóa Học lớp 11 Đề 5