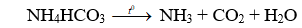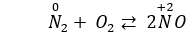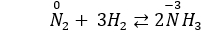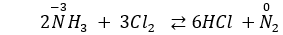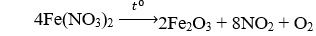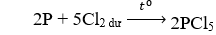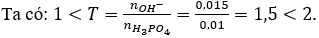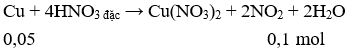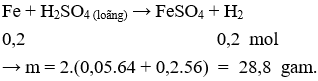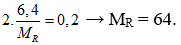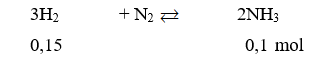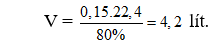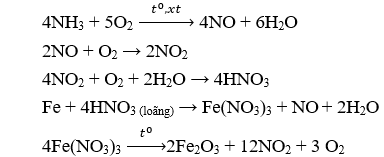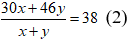Đề kiểm tra Giữa kì 1, Môn: Hóa Học lớp 11, (Đề 6)
Cập nhật: 14/12/2022
Đề thi Giữa kì 1
Môn: Hóa Học lớp 11
Thời gian làm bài: 45 phút
(Đề 6)
Phần I: Trắc nghiệm
Câu 1: Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học do
A. nitơ có bán kính nguyên tử nhỏ.
B. nitơ có độ âm điện lớn nhất trongnhóm.
C. phân tử nitơ có liên kết ba rất bền.
D. phân tử nitơ không phân cực.
Câu 2: Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây?
A. (NH4)2SO4.
B. NH4HCO3.
C. CaCO3.
D. NH4NO2.
Câu 3: Dung dịch HNO3 đặc để lâu thường có màu vàng do
A. HNO3 tan nhiều trong nước.
B. HNO3 bị khử bởi các chất của môi trường
C. dung dịch HNO3 có tính oxi hóa mạnh.
D. dung dịch HNO3 có hoà tan một lượng nhỏ NO2.
Câu 4: Các số oxi hoá có thể có của photpho là
A. –3, +3, +5.
B. –3, +3, +5, 0.
C. +3, +5, 0.
D. –3, 0, +1, +3, +5.
Câu 5: Trong phân tử H3PO4 photpho có số oxi hóa là
A. +5.
B. +3.
C. -5.
D. -3.
Câu 6: Thành phần chính của supephotphat đơn gồm
A. Ca(H2PO4)2.
B. Ca(H2PO4)2,CaSO4.
C. CaHPO4,CaSO4.
D. CaHPO4.
Câu 7: Thuốc thử để phân biệt hai dung dịch Na3PO4 và NaNO3 là
A. AgNO3.
B. NaOH.
C. KOH.
D. HCl.
Câu 8: Cho các phản ứng: N2 + O2 ⇌ 2NO và N2 + 3H2 ⇌ 2NH3. Trong hai phản ứng trên thì nitơ
A. chỉ thể hiện tính oxi hóa.
B. chỉ thể hiện tính khử.
C. thể hiện cả tính khử và tính oxi hóa.
D. không thể hiện tính khử và tính oxi hóa.
Câu 9: Cho phản ứng: 2NH3 + 3Cl2 ⇌ 6HCl +N2. Kết luận nào sau đây đúng?
A. NH3 là chất khử.
B. NH3 là chất oxi hoá.
C. Cl2 vừa oxi hoá vừa khử.
D. Cl2 là chất khử.
Câu 10. Khi cho kim loại Cu phản ứng với HNO3 tạo thành khí độc hại. Biện pháp nào xử lý tốt nhất để chống ô nhiễm môi trường?
A. Nút ống nghiệm bằng bông tẩm nước.
B. Nút ống nghiệm bằng bông tẩm cồn.
C. Nút ống nghiệm bằng bông tẩm giấm.
D. Nút ống nghiệm bằng bông tẩm nước vôi.
Câu 11. Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm
A. FeO, NO2, O2.
B. Fe2O3, NO2.
C. Fe2O3, NO2, O2.
D. Fe, NO2, O2.
Câu 12. Khi đốt cháy photpho trong khí Cl2 dư thì sản phẩm thu được là
A. PCl3.
B. PCl5.
C. PCl6.
D. PCl.
Câu 13. Dãy gồm tất cả các chất khi tác dụng với HNO3 thì HNO3 chỉ thể hiện tính axit là
A. CaCO3, Cu(OH)2, Fe(OH)2, FeO.
B. CuO, NaOH, FeCO3, Fe2O3.
C. Fe(OH)3, Na2CO3, Fe2O3,NH3.
D. KOH, FeS, K2CO3, Cu(OH)2.
Câu 14. Phân đạm 2 lá là
A. NH4Cl.
B. NH4NO3.
C. (NH4)2SO4.
D. NaNO3.
Câu 15. Thuốc thử dùng để phân biệt ba dung dịch muối NaNO3, Na3PO4, NaCl là
A. AgNO3.
B. BaCl2.
C. NaOH.
D. H2SO4.
Câu 16. Phân bón nào sau đây có hàm lượng đạm cao nhất?
A. NH4Cl.
B. NH4NO3.
C. (NH2)2CO.
D. (NH4)2SO4.
Câu 17. Trộn 100 ml dung dịch NaOH 0,15M với 100 ml dung dịch H3PO4 0,1M thì thu được dung dịch X gồm
A. Na2HPO4 và NaH2PO4.
B. Na3PO4 và Na2HPO4.
C. Na3PO4 và NH2PO4.
D. Na3PO4 và NaOHdư.
Câu 18. Chia m gam hỗn hợp X gồm hai kim loại Cu, Fe thành hai phần bằng nhau.
Phần 1: Tác dụng hoàn toàn với HNO3 đặc, nguội thu được 2,24 khí NO2 (đktc).
Phần 2: Tác dụng hoàn toàn với dung dịch H2SO4 loãng, dư thu được 4,48 lít khí (đktc) Giá trị của m là (Cho Cu = 64; Fe = 56)
A. 4,96.
B. 28,8.
C. 4,16.
D. 17,6.
Câu 19. Hòa tan hoàn toàn 6,4 gam kim loại R có hóa trị II trong dung dịch HNO3 dư thu được 4,48 lít khí NO2 (đktc) là sản phẩm khử duy nhất. Kim loại R là (Cho: Zn = 65, Cu = 64, Al = 27, Fe = 56)
A. Zn.
B. Cu.
C. Al.
D. Fe.
Câu 20: Thực hiện phản ứng giữa H2 và N2 trong bình kín có xúc tác thu được 1,7 gam NH3 với hiệu suất phản ứng là 80%. Thể tích H2 (đktc) cần dùng cho phản ứng là (Cho: N = 14, H = 1)
A. 4,2 lít.
B. 2,4 lít.
C. 4 lít.
D. 5lít.
Phần II: Tự luận
Câu 1: Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện phản ứng nếu có):
NH3 → NO → NO2→ HNO3 → Fe(NO3)3 → Fe2O3.
Câu 2: Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ lệ mol 1:1) bằng lượng dư dung dịch HNO3 thu được V lít hỗn hợp khí X gồm NO và NO2 (không có sản phẩm khử khác). Tỉ khối của X đối với H2 bằng 19. Tính V. (Cho: Fe = 56, Cu = 64, N = 14, O = 16, H = 1)
Đáp án & Hướng dẫn giải
Phần I: Trắc nghiệm
Câu 1. C
Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học do trong phân tử có liên kết ba rất bền.
Câu 2. B
Câu 3. D
Axit nitric kém bền. Ngay điều kiện thường, khi có ánh sáng dung dịch HNO3 bị phân hủy một phần giải phóng NO2. Khí này tan trong dung dịch axit, làm cho dung dịch có màu vàng.
Câu 4. B
Các số oxi hóa có thể có của photpho là -3, 0, +3, +5.
Câu 5. A
Gọi số oxi hóa của P là x có: 3.(+1) + x + 4.(-2) = 0 → x = + 5.
Câu 6. B
Thành phần chính của supephotphat đơn gồm Ca(H2PO4)2,CaSO4.
Câu 7. A
AgNO3 + NaNO3 → không phản ứng
Na3PO4 + 3AgNO3 → 3NaNO3 + Ag3PO4 (↓ vàng)
Câu 8. C
Số oxi hóa của N tăng từ 0 lên +2, vậy N2 thể hiện tính khử.
Số oxi hóa của N giảm từ 0 xuống -3, vậy N2 thể hiện tính oxi hóa.
Câu 9. A
Số oxi hóa của N tăng từ -3 lên 0. Vậy NH3 là chất khử.
Câu 10. D
4NO2 + 2Ca(OH)2 → Ca(NO2)2 + Ca(NO3)2 + 2H2O
Câu 11. C
Câu 12. B
Câu 13. C
Fe(OH)3 + 3HNO3 → Fe(NO3)3 + 3H2O
Na2CO3 + 2HNO3 → 2NaNO3 + CO2 + H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
NH3 + HNO3 → NH4NO3.
Câu 14. B
Đạm hai lá: NH4NO3.
Câu 15. A
Sử dụng AgNO3 làm thuốc thử.
+ Không có hiện tượng → NaNO3.
+ Có kết tủa trắng → NaCl
NaCl + AgNO3 → AgCl (↓ trắng) + NaNO3
+ Có kết tủa vàng → Na3PO4.
Na3PO4 + 3AgNO3 → 3NaNO3 + Ag3PO4 (↓ vàng)
Câu 16. C
Ure ( (NH2)2CO ) có hàm lượng đạm cao nhất.
Câu 17. A
Vậy dung dịch X gồm hai muối: Na2HPO4 và NaH2PO4.
Câu 18. B
Phần I. Cho X tác dụng với HNO3 đặc, nguội chỉ có Cu phản ứng.
Phần II. Cho X tác dụng với H2SO4 loãng, dư chỉ có Fe phản ứng
Câu 19. B
Bảo toàn electron có:
Vậy kim loại R là Cu.
Câu 20. A
Do hiệu suất phản ứng là 80% nên thể tích H2 cần dùng là:
Phần II: Tự luận
Câu 1.
Câu 2.
Gọi nFe = nCu = a → 56a + 64a = 12 → a = 0,1 (mol)
Gọi số mol NO và NO2 lần lượt là x và y (mol)
Bảo toàn electron có: 3x + y = 3.nFe + 2.nCu = 0,5 (1)
Có MX = 19.2 = 38 →
Từ (1) và (2) có: x = y = 0,125 (mol)
Vậy V = (0,125 + 0,125).22,4 = 5,6 lít.
Nguồn: /
Tags : Đề kiểm tra Giữa kì 1 Hóa Học lớp 11 Đề 6