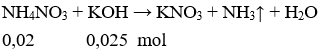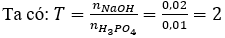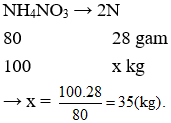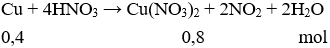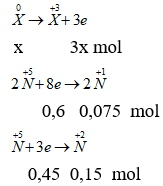Đề kiểm tra Giữa kì 1, Môn: Hóa Học lớp 11, (Đề 8)
Cập nhật: 14/12/2022
Đề thi Giữa kì 1
Môn: Hóa Học lớp 11
Thời gian làm bài: 45 phút
(Đề 8)
Câu 1: Để nhận biết ion photphat ( PO43-), người ta sử dụng thuốc thử
A. Dung dịch AgNO3.
B. Quỳ tím.
C. Dung dịch NaOH.
D. Dung dịch BaCl2.
Câu 2: Chỉ ra nội dung sai:
A. Trong nhóm nitơ, khả năng oxi hoá của các nguyên tố tăng dần từ nitơ đến photpho.
B. Trong các hợp chất, nitơ có thể có các số oxi hoá –3, +1, +2, +3, +4, +5.
C. Trong các hợp chất, các nguyên tố nhóm nitơ có số oxi hoá cao nhất là +5.
D. Các nguyên tố nhóm nitơ thể hiện tính oxi hoá và tính khử.
Câu 3: Cho Cu tác dụng với dung dịch HNO3 loãng tạo ra khí A không màu, hóa nâu ngoài không khí. Cho Fe tác dụng với dung dịch HNO3 tạo ra khí B màu nâu đỏ. A và B lần lượt là
A. NO và NO2.
B. NO2 và NO.
C. NO và N2O.
D. N2 và NO.
Câu 4: Cho 200ml dung dịch NH4NO3 0,1M tác dụng với 250 ml dung dịch KOH 0,1 M. Sau phản ứng thu được thể tích khí là
A. 0,56 lit.
B. 0,224 lit.
C. 0,448 lit.
D. 0,672 lit.
Câu 5: Thuốc thử để nhận biết khí NH3 là
A. Dung dịch NaOH.
B. Quỳ tím ẩm.
C. Dung dịch KCl.
D. Quỳ tím khô.
Câu 6: Cho các kim loại sau : Mg, Al, Cu, Ag, Fe, Cr, Zn, Ca. Số kim loại tác dụng được với dung dịch axit HNO3 đặc, nguội là
A. 3.
B. 4.
C. 5.
D. 6.
Câu 7: Hệ số cân bằng của HNO3 trong phản ứng:
Cu + HNO3 → Cu(NO3)2 + NO + H2O là
A. 3.
B. 2.
C. 4.
D. 8.
Câu 8: Câu trả lời nào dưới đây không đúng khi nói về axit photphoric?
A. Axit photphoric là axit ba nấc.
B. Axit photphoric là axit có độ mạnh trung bình
C. Axit photphoric có tính oxi hóa rất mạnh.
D. Axit photphoric làm quỳ tím chuyển màu đỏ.
Câu 9: Chỉ ra nội dung đúng?
A. Thành phần chính của supephotphat đơn và supephotphat kép là muối canxi hiđrophotphat.
B. Supephotphat đơn chứa Ca(H2PO4)2 và CaSO4; supephotphat kép chứa Ca(H2PO4)2.
C. Supephotphat đơn và supephotphat kép đều sản xuất qua hai giai đoạn.
D. Supephotphat đơn sản xuất qua hai giai đoạn.
Câu 10: Nhiệt phân hoàn toàn 17,0 gam AgNO3 thu được a gam kim loại. Giá trị của a là
A. 2,7 gam.
B. 10,8 gam.
C. 5,4 gam.
D. 13,5 gam.
Câu 11: Chỉ ra nội dung đúng:
A. Photpho đỏ độc, kém bền trong không khí ở nhiệt độ thường.
B. Khi làm lạnh, hơi của photpho trắng chuyển thành photpho đỏ.
C. Photpho đỏ có cấu trúc polime.
D. Photpho đỏ không tan trong nước, nhưng tan tốt trong các dung môi hữu cơ như benzen, ete...
Câu 12: Hai khoáng vật chính của photpho là
A. Photphorit và đolomit.
B. Apatit và đolomit.
C. Photphorit và cacnalit.
D. Apatit và photphorit.
Câu 13: Cho 33,6 gam hỗn hợp Mg, Cu tác dụng vừa đủ với dung dịch HNO3 loãng thu được 13,44 lit NO ( duy nhất ở đktc). Khối lượng Mg, Cu trong hỗn hợp lần lượt là
A. 12,4 và 21,2.
B. 19,2 và 14,4.
C. 21,2 và 12,4.
D. 14,4 và 19,2.
Câu 14: Cho 200 ml dung dịch NaOH 0,1 M tác dụng với 100 ml dung dịch H3PO4 0,1 M. Sau phản ứng thu được muối là
A. NaH2PO4.
B. Na3PO4.
C. Na2HPO4.
D. NaH2PO4 và Na2HPO4.
Câu 15: Chỉ ra nội dung sai:
A. Muối amoni không tác dụng được với dung dịch kiềm
B. Tất cả muối amoni đều dễ tan trong nước.
C. Ion amoni có công thức là NH4+
D. Muối amoni khi tan điện li hoàn toàn.
Câu 16: Khối lượng N có trong 100 kg phân đạm NH4NO3 là
A. 70 kg.
B. 35 kg.
C. 17,5 kg.
D. Đáp án khác.
Câu 17: Cho các muối nitrat: NaNO3, Cu(NO3)2, Mg(NO3)2, Fe(NO3)3, AgNO3, KNO3, Pb(NO3)2, Al(NO3)3. Có bao nhiêu muối nitrat khi bị nhiệt phân sinh ra oxit kim loại, NO2 và O2?
A. 2.
B. 3.
C. 4.
D. 5.
Câu 18: Trong công nghiệp, phần lớn lượng nitơ sản xuất ra được dùng để
A. tổng hợp phân đạm.
B. tổng hợp amoniac.
C. sản xuất axit nitric.
D. làm môi trường trơ trong luyện kim, điện tử...
Câu 19: Cho 31,2 gam hỗn hợp Fe, Cu tác dụng với dung dịch HNO3 đặc, nguội, dư thu được 17,92 lit khí màu nâu đỏ. Khối lượng Fe trong hỗn hợp là
A. 4,4 gam.
B. 1,2 gam.
C. 28,8 gam.
D. 5,6 gam.
Câu 20: Trong các loại phân đạm sau: NH4Cl, (NH4)2SO4, NaNO3, (NH2)2CO. Phân đạm có hàm lượng Nitơ cao nhất là
A. NaNO3.
B. NH4Cl.
C. (NH4)2SO4.
D. (NH2)2CO.
Câu 21. Hoà tan hoàn toàn 9,45 gam kim loại X có hóa trị cao nhất là III bằng HNO3 loãng thu được 5,04 lít (đktc) hỗn hợp khí N2O và NO (không có sản phẩm khử khác), trong đó số mol NO gấp 2 lần số mol N2O. Kim loại X là
A. Zn.
B. Cr.
C. Al.
D. Fe.
Câu 22. Hòa tan hoàn toàn 6,5 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,224 lít khí N2 (đktc). Khối lượng muối trong dung dịch X là
A. 18,90 gam.
B. 17,80 gam.
C. 19,9 gam.
D. 28,35 gam.
Câu 23. Cho 2,7 gam Al tác dụng hết với dung dịch HNO3 (dư), sinh ra 2,24 lít khí X (sản phẩm khử duy nhất, ở đktc). Khí X là
A. N2O.
B. NO2.
C. N2.
D. NO.
Câu 24. Cho 22,72 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư thu được V lít khí NO duy nhất (ở đktc) và dung dịch X. Cô cạn dung dịch X thu được 77,44 gam muối khan. Giá trị của V là
A. 2,688 lít.
B. 2,24 lít.
C. 4,48 lít.
D. 5,6 lít.
Câu 25. Cho phản ứng hóa học sau:
FeO + HNO3 → Fe(NO3)3 + NO + H2O
Tổng hệ số cân bằng (là các số nguyên và tối giản) của phản ứng hóa học đó là
A. 15.
B. 25.
C. 24.
D. 22.
Đáp án & Hướng dẫn giải
Câu 1. A
Để nhận biết ion photphat dùng AgNO3.
3Ag+ + PO43- → Ag3PO4↓ vàng.
Câu 2. A
Trong nhóm nitơ, khả năng oxi hoá của các nguyên tố giảm dần từ nitơ đến photpho.
Câu 3. A
A là khí không màu hóa nâu ngoài không khí → A là NO.
2NO (không màu) + O2 → 2NO2 (nâu đỏ)
B là khí có màu nâu đỏ → B là NO2.
Câu 4. C
Vậy NH4NO3 hết, nkhí = nNH4NO3 = 0,02 mol
→ Vkhí = 0,02.22,4 = 0,448 lít.
Câu 5. B
Khí NH3 làm xanh quỳ tím ẩm.
Câu 6. C
Các kim loại tác dụng được với HNO3 đặc, nguội là: Mg, Cu, Ag, Zn, Ca.
Câu 7. D
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Câu 8. C
Axit photphoric không có tính oxi hóa.
Câu 9. B
A sai vì thành phần chính của supephotphat đơn là Ca(H2PO4)2 và CaSO4.
C, D sai vì supephotphat đơn được sản xuất qua 1 giai đoạn.
Câu 10. B
Bảo toàn Ag có: nAg = nMuối = 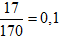
→ a = 0,1.108 = 10,8 gam.
Câu 11. C
A sai vì photpho đỏ bền trong không khí ở nhiệt độ thường.
B sai vì khi làm lạnh hơi P đỏ chuyển thành P trắng.
D sai vì photpho đỏ không tan trong các dung môi thông thường.
Câu 12. D
Hai khoáng vật chính của photpho là Apatit và photphorit.
Câu 13. D
Gọi số mol của Mg và Cu lần lượt là x và y mol.
mhh = 33,6 gam → 24x + 64y = 33,6 (1)
Bảo toàn electron có: 2x + 2y = 3.nNO = 1,8 (2)
Từ (1) và (2) có x = 0,6 và y = 0,3
Khối lượng Mg, Cu trong hỗn hợp lần lượt là 14,4 gam và 19,2 gam.
Câu 14. C
Vậy sau phản ứng thu được: Na2HPO4.
Câu 15. A
Muối amoni tác dụng với dung dịch kiềm giải phóng NH3
Ví dụ:
NH4Cl + NaOH → NH3 + NaCl + H2O.
Câu 16. B
Câu 17. D
Các muối nitrat của các kim loại từ Mg đến Cu trong dãy hoạt động hóa học khi nhiệt phân sinh ra oxit kim loại, NO2 và O2.
→ Các muối thỏa mãn đề bài: Cu(NO3)2, Mg(NO3)2, Fe(NO3)3, Pb(NO3)2, Al(NO3)3.
Câu 18. B
Trong công nghiệp, phần lớn lượng nitơ được sản xuất ta được dùng để tổng hợp amoniac từ đó điều chế ra axit nitric, phân đạm....
Câu 19. D
Cho Fe, Cu tác dụng với HNO3đặc, nguội chỉ có Cu phản ứng.
mFe = 31,2 – 0,4.64 = 5,6 gam.
Câu 20. D
Ure: (NH2)2CO có hàm lượng N cao nhất.
Câu 21. C
nhh khí = 5,04 : 22,4 = 0,225 mol
Gọi số mol N2O là a → nNO = 2a → a = 0,075 mol
Gọi số mol X là x mol. Theo bài ra ta có các quá trình:
Áp dụng định luật bảo toàn số mol electron ta có: ne nhường = ne nhận
→ 3x = 0,6 + 0,45
→ x = 0,35 → MX = 9,45 : 0,35 = 27 → X là Nhôm.
Câu 22. C
nZn = 0,1 mol; nN2 = 0,01 mol.
Giả sử sản phẩm khử sinh ra chỉ có N2. Ta có nZn.2 = 0,2 ≠ nN2.10 = 0,1.
Vậy còn có sản phẩm khử là NH4NO3 x mol
Áp dụng định luật bảo toàn electron có: nZn.2 = nN2.10 + nNH4NO3.8
→ nNH4NO3 = 0,0125 mol.
Muối trong X gồm Zn(NO3)2 và NH4NO3.
Bảo toàn nguyên tố Zn có nZn(NO3)2 = nZn = 0,1
→ mmuối = 0,1.(65 + 62.2) + 0,0125.(18 +62) = 19,9 gam.
Câu 23. D
nAl = 0,1 mol; nx = 0,1 mol
Áp dụng định luật bảo toàn electron có:
3.nAl = nx. n ( với n là số e nhận)
→ 0,1.3 = 0,1.n → n = 3. Vậy khí X là NO.
Câu 24. A
Quy đổi hỗn hợp sắt và oxit sắt thành hỗn hợp gồm Fe (x mol) và O (y mol).
→ 56x + 16y = 22,72.
mmuối = mFe(NO3)3 = 0,32 mol.
Bảo toàn Fe có nFe = x = nmuối = 0,32 mol → y = 0,3 mol.
Áp dụng định luật bảo toàn electron có:
nFe.3 = nO.2 + nNO.3 → nNO= 0,12
→ V = 0,12.22,4 = 2,688 lít.
Câu 25. D
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Tổng hệ số cân bằng = 3 + 10 + 3 + 1 + 5 = 22.
Nguồn: /
Tags : Đề kiểm tra Giữa kì 1 Hóa Học lớp 11 Đề 8