Đề thi Giữa Học kì 1, Năm học 2022 - 2023, Bài thi môn: Hóa Học lớp 11, (Đề số 9)
Cập nhật: 14/12/2022
Đề thi Giữa Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa Học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 9)
Phần I. Trắc nghiệm (2,5 điểm)
Câu 1:Cho dãy các chất sau: HCl, H2SO4, H3PO4, NaOH, C2H5OH, Ba(OH)2, Fe(NO3)3, NH4Cl, KAlO2. Số chất điện li mạnh là:
A. 6 B. 7 C. 8 D. 9
Câu 2: Cho các chất sau: KOH, Ca(OH)2, Al(OH)3, Zn(OH)2, Sn(OH)2và Pb(OH)2. Số chất có tính chất lưỡng tính là:
A. 2. B. 3 C. 4 D. 5
Câu 3: Khi trộn 100 ml dung dịch Ba(OH)2 0,125M với 400 ml dung dịch HCl 0,05M thu được dung dịch có pH là:
A. 2 B. 6 C. 10 D. 12
Câu 4: Dãy gồm các ion có thể cùng tồn tại trong một dung dịch là:
A. NH4+, NO3-, HCO3-, OH- B. K+, H+, SO42-, OH-
C. Na+, NH4+, H+,CO32- D. Ca2+, Fe2+, NO3-, Cl-
Câu 5: Thể tích dung dịch HNO30,3M vừa đủ để trung hòa 100 ml dung dịch chứa hỗn hp NaOH 0,1M và Ba(OH)20,1M là
A. 100 ml B. 150ml C. 200 ml D. 250 ml
Câu 6: Cho phản ứng hóa học NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion rút gọn với phản ứng trên?
A. 2KOH + FeCl2→ Fe(OH)2+ 2KCl
B. NaOH + NaHCO3→ Na2CO3+ H2O
C. NaOH + NH4Cl → NaCl + NH3+ H2O
D. KOH + HNO3→ KNO3+ H2O
Câu 7: Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein. Hiện tượng xảy ra trong thí nghiệm là:
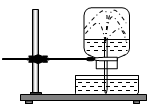
A. Nước phun vào bình và chuyển thành màu xanh.
B. Nước phun vào bình và chuyển thành màu hồng.
C. Nước phun vào bình và không có màu.
D. Nước phun vào bình và chuyển thành màu tím.
Câu 8: Hòa tan hoàn toàn 13 gam Zn trong dung dịch HNO3loãng, dư thu được dung dịch X và 0,448 lít khí N2(đktc). Khối lượng muối trong dung dịch X là:
A. 37,8 gam B. 18,9 gam C. 28,35 gam D. 39,8 gam
Câu 9: Dung dịch X gồm a mol Na+; 0,15 mol K+; 0,1 mol HCO3-; 0,15 mol CO32-và 0,05 mol SO42-. Tổng khối lượng muối trong dung dịch X là:
A. 33,8 gam B. 28,5 gam C. 29,5 gam D. 31,3 gam
Câu 10: Cho 3,2 gam Cu tác dụng với 100 ml dung dịch gồm HNO30,8M và H2SO40,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là:
A. 0,448 B. 0,792 C. 0,672 D. 0,746
Phần II: Tự luận.7,5 điểm
Câu 1: (2,0 điểm)
Chỉ dùng một hóa chất, hãy trình bày phương pháp hóa học phân biệt ba dung dịch sau đụng trong các lọ mất nhãn sau: NH4Cl, (NH4)2SO4và KNO3. Viết các phương trình hóa học xảy ra.
Câu 2: (2,0 điểm)
Viết phương trình phản ứng thực hiện dãy biến hóa sau (ghi rõ điều kiện nếu có)
NH4NO2→ N2→ NH3→ NO → NO2→ HNO3→ Cu(NO3)2→ O2
↓
Al(OH)3
Câu 3: (3,5 điểm)
Hòa tan hoàn toàn 23,6 gam hỗn hợp gồm Cu và Fe vào dung dịch HNO32M (dư), thu được dung dịch A và 7,84 lít khí NO (sản phẩm khử duy nhất ở đktc)
1. Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp đầu.
2. Tính khối lượng muối khan thu được khi cô cạn dung dịch A.
3. Tính thể tích của dung dịch HNO3ban đầu (biết rằng dùng dư 10% so với lượng cần phản ứng)
Nguồn: /

