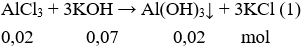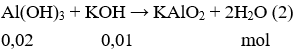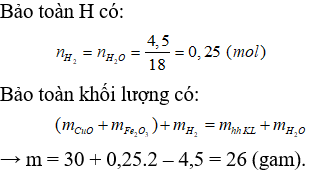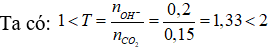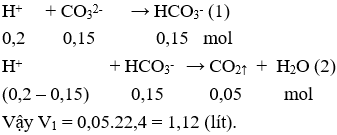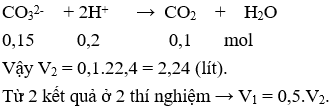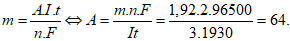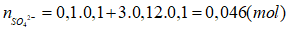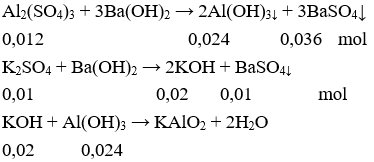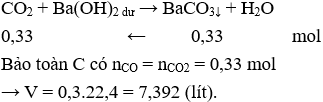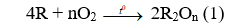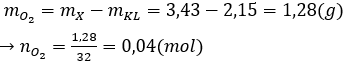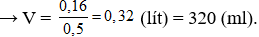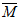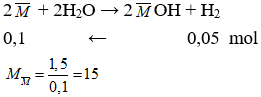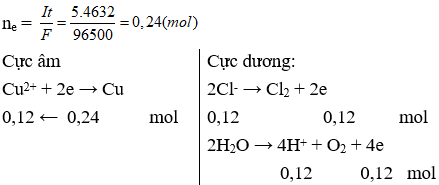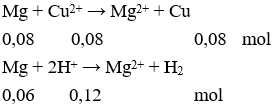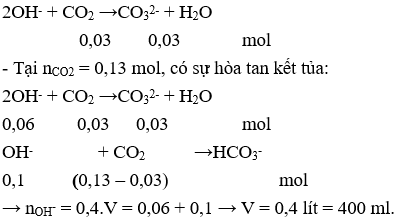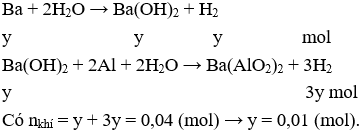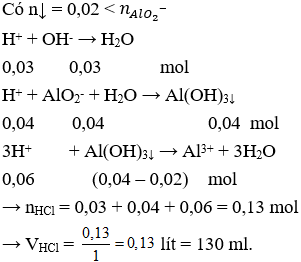Đề thi Giữa học kì 2, Môn: Hóa Học 12, (Đề 1)
Cập nhật: 14/12/2022
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 1)
Câu 1: Dẫn hỗn hợp khí gồm CO2, O2, N2 và H2 qua dung dịch NaOH. Khí bị hấp thụ là
A. N2.
B. H2.
C. CO2.
D. O2.
Câu 2: Cho 700 ml dung dịch KOH 0,1M vào 100 ml dung dịch AlCl3 0,2M. Sau phản ứng, khối lượng kết tủa tạo ra là
A. 0,97g.
B. 0,78g.
C. 1,56g.
D. 0,68g.
Câu 3: Kim loại Al có thể khử được oxit nào sau đây ở nhiệt độ cao
A. CuO.
B. BaO.
C. MgO.
D. CaO.
Câu 4: Để khử hoá hoàn toàn 30 gam hỗn hợp rắn gồm CuO và Fe2O3 bằng khí H2, thu được m gam hỗn hợp kim loại và 4,5 gam H2O. Giá trị của m là
A. 22 gam.
B. 24 gam.
C. 26 gam.
D. 28 gam.
Câu 5: Để làm sạch lớp cặn trong các dụng cụ đun và chứa nước nóng, người ta dùng
A. giấm ăn.
B. dung dịch muối ăn.
C. ancol etylic.
D. nước vôi trong.
Câu 6: Phương pháp không dùng để điều chế kim loại là
A. Dùng Fe khử CuSO4 trong dung dịch.
B. Điện phân nóng chảy Al2O3.
C. Dùng CO khử Al2O3 ở nhiệt độ cao.
D. Điện phân dung dịch CuSO4.
Câu 7: Có các thông tin về kim loại kiềm: (1) dẫn điện tốt, (2) nhiệt độ sôi thấp so với các kim loại khác, (3) màu trắng xám, (4) mềm. Thông tin chính xác là
A. 2, 4.
B. 1, 2, 4.
C. 2, 3, 4.
D. 1, 2, 3, 4.
Câu 8: Hấp thụ hoàn toàn 3,36 lít khí CO2 ở đktc vào 100 ml dung dịch Ca(OH)2 1M thu được m gam kết tủa. Giá trị của m là
A. 10.
B. 15.
C. 7,5.
D. 5.
Câu 9: Hợp chất nào sau đây không có tính lưỡng tính ?
A. Al2O3.
B. AlCl3.
C. Zn(OH)2.
D. NaHCO3.
Câu 10: Khi điện phân dung dịch NaCl (cực âm bằng sắt, cực dương bằng than chì, màng ngăn xốp) thì
A. ở cực âm xảy ra quá trình oxi hoá H2O và ở cực dương xảy ra quá trình khử Cl-
B. ở cực âm xảy ra quá trình khử Na+ và ở cực dương xảy ra quá trình oxi hoá Cl-
C. ở cực dương xảy ra quá trình oxi hoá Na+ và ở cực âm xảy ra quá trình khử Cl-
D. ở cực âm xảy ra quá trình khử H2O và ở cực dương xảy ra quá trình oxi hoá ion Cl-
Câu 11: Để phân biệt các dung dịch riêng biệt: NaCl, MgCl2, AlCl3, FeCl3, có thể dùng dung dịch
A. HNO3.
B. Na2SO4.
C. NaOH.
D. HCl.
Câu 12: Các nguyên tố nào sau đây thuộc nhóm kim loại kiềm?
A. Li, Na, K, Sr, Cs.
B. Li, K, Na, Ba, Rb.
C. Li, Na, K, Rb, Cs.
D. Li, Na, Ca, K, Rb.
Câu 13: Tiến hành 2 thí nghiệm sau:
TN1. Cho từ từ 200ml dung dịch HCl 1M vào 150ml dung dịch Na2CO3 1M thu được V1 lít khí CO2.
TN2. Cho từ từ 150ml dung dịch Na2CO3 1M vào 200ml dung dịch HCl 1M thu được V2 lít khí CO2.
Các thể tích khí đo ở cùng điều kiện. Quan hệ của V1 và V2 là
A. V1 = 0,5V2.
B. V1 = 1,5V2.
C. V1 = V2.
D. V1 = 0,25V2.
Câu 14: Khẳng định nào sau đây là đúng khi nói về tính chất vật lý của kim loại
A. độ cứng lớn nhất là Cu.
B. khối lượng riêng lớn nhất là Os.
C. nhiệt độ nóng chảy thấp nhất là Cs.
D. dẫn điện tốt nhất là Cu.
Câu 15: Điện phân (với điện cực trơ) dung dịch muối sunfat của một kim loại hóa trị II với I = 3A. Sau 1930 giây điện phân thấy khối lượng catot tăng 1,92g. Kim loại đó là
A. Zn.
B. Ba.
C. Ca.
D. Cu.
Câu 16: Dung dịch X gồm K2SO4 0,1M và Al2(SO4)3 0,12M. Cho rất từ từ dung dịch Ba(OH)2 vào 100 ml dung dịch X thì khối lượng kết tủa lớn nhất thu được là
A. 11,03.
B. 10,94.
C. 12,59.
D. 11,82.
Câu 17: Đốt cháy kim loại kiềm nào sau đây cho ngọn lửa màu vàng?
A. Rb.
B. Na.
C. Cs.
D. Li.
Câu 18: Dùng V lít CO (đktc) thổi qua Fe2O3 dư. Khí sinh ra cho hết vào bình Ba(OH)2 dư thì thu được 65,01 gam kết tủa. Giá trị của V là
A. 5,376 lít.
B. 6,272 lít.
C. 7,392 lít.
D. 8,736 lít.
Câu 19: Đốt cháy 2,15 gam hỗn hợp gồm Zn, Al và Mg trong khí oxi dư, thu được 3,43 gam hỗn hợp X. Cho X phản ứng vừa đủ với V ml dung dịch HCl 0,5M. Biết các phản ứng xảy ra hoàn toàn. Giá trị của V là
A. 160.
B. 480.
C. 240.
D. 320.
Câu 20: Cho 1,5 gam hỗn hợp gồm Na và kim loại kiềm X tác dụng với nước, thu được 1,12 lít H2 (đktc). X là
A. Li.
B. K.
C. Rb.
D. Na.
Câu 21: Điện phân dung dịch chứa 0,2 mol CuSO4 và 0,12 mol NaCl bằng điện cực trơ, với cường độ dòng điện không đổi I = 5A trong thời gian 4632 giây thì dừng điện phân. Nhúng thanh Mg vào dung dịch sau điện phân, kết thúc phản ứng, khối lượng thanh Mg thay đổi như thế nào so với trước phản ứng. Giả thiết hiệu suất điện phân là 100%.
A. giảm 3,36 gam.
B. tăng 3,20 gam.
C. không thay đổi.
D. tăng 1,76 gam.
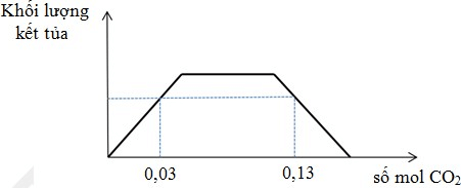
Câu 22: Sục khí CO2 vào V lít dung dịch hỗn hợp NaOH 0,2 M và Ba(OH)2 0,1M. Đồ thị biểu diễn khối lượng kết tủa theo số mol CO2 như sau:
Giá trị của V là
A. 300.
B. 250.
C. 150.
D. 400.
Câu 23: Ở trạng thái cơ bản, nguyên tử kim loại kiềm thổ có số electron hóa trị là
A. 1e.
B. 2e.
C. 4e.
D. 3e.
Câu 24: Chia m gam hỗn hợp X gồm kim loại Al và Ba thành 2 phần bằng nhau.
Phần 1: Cho vào nước dư thu được 896 ml khí (đktc).
Phần 2: Cho vào 50 ml dung dịch NaOH 1M (dư) thu được 1568 ml khí (đktc) và dung dịch Y. Cho V ml dung dịch HCl 1M vào Y thu được 1,56 gam kết tủa. Giá trị của V lớn nhất để thu được lượng kết tủa trên là
A. 130.
B. 20.
C. 100.
D. 50.
Câu 25: Trong các ion sau đây, ion nào có tính oxi hóa mạnh nhất?
A. Cu2+.
B. Ag+.
C. Zn2+.
D. Ca2+.
Câu 26: Có các thí nghiệm sau
(a) Dẫn khí NH3 vào dung dịch AlCl3
(b) Dẫn khí etilen vào dung dịch thuốc tím
(c) Trộn lẫn dung dịch NaOH với dung dịch Ca(HCO3)2
(d) Dẫn khí CO2 cho tới dư vào dung dịch Ba(OH)2.
(e) Dẫn khí SO2 vào dung dịch H2S
(f) Cho mẩu K (dư) vào dung dịch ZnCl2
(g) Cho axit photphoric vào dung dịch nước vôi trong dư
Có bao nhiêu thí nghiệm thu được kết tủa khi kết thúc các phản ứng?
A. 5.
B. 3.
C. 6.
D. 4.
Câu 27: X là kim loại có nhiệt độ nóng chảy cao nhất, được sử dụng để làm sợi tóc bóng đèn thay thế cho sợi than, sợi osimi. X là kim loại nào dưới đây?
A. Cs.
B. W.
C. Ag.
D. Cr.
Câu 28: Các chất nào sau đây đều tan được trong dung dịch NaOH
A. MgCO3, Al, CuO.
B. Na, Al, Al2O3.
C. KOH, CaCl2, Cu(OH)2.
D. Al(OH)3, Mg(OH)2, NaOH.
Câu 29: Nước cứng là nước có chứa nhiều ion nào?
A. Ca2+, Ba2+.
B. SO42-, Cl-.
C. Ca2+, Mg2+.
D. Ba2+, Mg2+.
Câu 30: Có các nhận xét sau:
(a) Kim loại mạnh luôn đẩy kim loại yếu hơn ra khỏi muối của nó.
(b) Những kim loại như Na, K, Ba, Ca chỉ có thể điều chế bằng cách điện phân nóng chảy.
(c) Tráng Sn lên sắt để sắt không bị ăn mòn là phương pháp bảo vệ kim loại bằng phương pháp điện hóa.
(d) Các kim loại kiềm có cùng kiểu cấu trúc mạng tinh thể
(e) Hầu hết các hợp chất của kim loại kiềm đều tan tốt trong nước
(f) Các muối của kim loại kiềm đều có môi trường trung tính.
(g) Kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa
Có bao nhiêu nhận xét đúng ?
A. 3.
B. 4.
C. 2.
D. 1.
Đáp án & Thang điểm
Câu 1. C
CO2 + 2NaOH → Na2CO3 + H2O
Câu 2. B
Sau khi phản ứng (1) xảy ra, vẫn còn KOH dư (0,01 mol). Tiếp tục có phản ứng:
Sau phản ứng (2) Al(OH)3 ↓ còn 0,01 mol
→ m↓ = 0,01.78 = 0,78 (gam).
Câu 3. A
Al có thể khử được oxit của các kim loại đứng sau nó trong dãy hoạt động hóa học.
Câu 4. C
Câu 5. A
Lớp cặn trong các dụng cụ đun và chứa nước nóng phần lớn là MgCO3 và CaCO3.
MgCO3 + 2CH3COOH → (CH3COO)2Mg + CO2 + H2O
CaCO3 + 2CH3COOH → (CH3COO)2Ca + CO2 + H2O
Câu 6. C
CO chỉ khử được oxit của các kim loại đứng sau nhôm trong dãy hoạt động hóa học của kim loại.
Câu 7. B
(3) sai vì kim loại kiểm có màu trắng bạc.
Câu 8. D
Nên sau phản ứng thu được hai muối: CaCO3 (x mol) và Ca(HCO3)2 (y mol)
Bảo toàn Ca có: x + y = nCa(OH)2 = 0,1 (1)
Bảo toàn C có: x + 2y = nCO2 = 0,15 (2)
Từ (1) và (2) có x = y = 0,05 (mol)
Kết tủa là CaCO3 → m = 0,05.100 = 5 (gam).
Câu 9. B
AlCl3 không có tính lưỡng tính.
Câu 10. D
Cực dương Cl- bị oxi hóa: 2Cl- → Cl2 + 2e
Cực âm Na+ không bị khử, thay vào đó H2O bị khử: 2H2O + 2e → H2 + 2OH-
Câu 11. C
Sử dụng dung dịch NaOH để phân biệt
- Không có hiện tượng xảy ra → NaCl.
- Có kết tủa nâu đỏ → FeCl3
FeCl3 + 3NaOH → Fe(OH)3↓ nâu đỏ + 3NaCl.
- Có kết tủa keo trắng, sau đó kết tủa tan dần khi NaOH dư → AlCl3
AlCl3 + 3NaOH → Al(OH)3↓ keo trắng + 3NaCl
Al(OH)3↓ + NaOHdư → NaAlO2 + 2H2O.
- Có kết tủa trắng, không tan khi NaOH dư → MgCl2
MgCl2 + 2NaOH → Mg(OH)2↓ trắng + 2NaCl.
Câu 12. C
Nhóm kim loại kiềm: nhóm IA.
A sai vì Sr thuộc nhóm IIA.
B sai vì Ba thuộc nhóm IIA.
D sai vì Ca thuộc nhóm IIA.
Câu 13. A
Thí nghiệm 1: Phản ứng xảy ra theo thứ tự:
Thí nghiệm 2: Phản ứng xảy ra:
Câu 14. B
A sai vì kim loại cứng nhất là Cr.
C kim loại có nhiệt độ thấp nhất là Hg (-39°C)
D kim loại dẫn điện tốt nhất là Ag.
Câu 15. D
Áp dụng công thức Farađay:
Vậy kim loại là đồng (Cu).
Câu 16. A
Để lượng kết tủa thu được là lớn nhất thì SO42- phản ứng hết, Ba(OH)2 không dư (nếu dư lại hòa tan Al(OH)3↓)
Vậy khối lượng kết tủa lớn nhất thu được là:
m = mAl(OH)3 + mBaSO4 = (0,024 – 0,02).78 + 0,046.233 = 11,03 (gam).
Câu 17. B
Na cháy cho ngọn lửa màu vàng.
Câu 18. C
Câu 19. D
Đặt hỗn hợp kim loại tương ứng với 1 kim loại là R có hóa trị n.
Do oxi dư nên sản phẩm sinh ra chỉ có oxit:
R2On + 2nHCl → 2RCln + nH2O (2)
Áp dụng định luật bảo toàn khối lượng có:
Bảo toàn O có nO(oxit) = 2.nO2 = 0,08 (mol)
Từ (2) có nHCl = 2.nO(oxit) = 0,16 (mol)
Câu 20. A
Đặt Na và X tương ứng với 1 kim loại là
Có MNa = 23 > 15 nên MX < 15. Vậy X là Li thỏa mãn.
Câu 21. D
Ta có:
Dung dịch sau điện phân gồm: Cu2+ dư 0,08 mol; SO42-: 0,2 mol; H+: 0,12 mol; Na+: 0,12 mol
Nhúng thanh Mg vào dung dịch sau điện phân:
Khối lượng thanh Mg thay đổi sau phản ứng là:
∆m = mCu – mMg pư = 0,08.64 – 0,14.24 = 1,76 (gam).
Vậy sau phản ứng thanh Mg tăng 1,76 gam.
Câu 22. D
nOH- = 0,4.V (mol)
- Tại nCO2 = 0,03 mol, chưa có sự hòa tan kết tủa:
Câu 23. B
Kim loại kiềm thổ nằm ở nhóm IIA trong BTH;
Số electron hóa trị = số thứ tự nhóm A = 2.
Câu 24. A
Gọi số mol Al và Ba trong mỗi phần lần lượt là x và y mol.
Có thể tích H2 ở phần 1, ít hơn so với ở phần 2 nên ở phần 1 có Al dư
Phần 1:
Phần 2: Cả Al và Ba đều hết
Bảo toàn electron có:
3.nAl + 2.nBa = 2.nkhí ↔ 3.x + 2.0,01 = 2. 0,07→ x = 0,04 (mol)
Dung dịch Y gồm: Na+: 0,05 mol; Ba2+: 0,01 mol; AlO2-: 0,04 mol; và OH-
Bảo toàn điện tích có nOH- (Y) = 0,05 + 2.0,01 – 0,04 = 0,03 (mol).
Cho HCl vào Y thu được kết tủa là Al(OH)3
Câu 25. B
Câu 26. A
(a) 3NH3 + AlCl3 + 3H2O → Al(OH)3↓ + 3NH4Cl
(b) 3CH2 = CH2 + 2KMnO4 + 4H2O → 3HO – CH2 – CH2 – OH + 2MnO2↓ + 2KOH
(c) 2NaOH + Ca(HCO3)2 → Na2CO3 + CaCO3↓ + 2H2O
(d) 2CO2 dư + Ba(OH)2 → Ba(HCO3)2.
e) SO2 + 2H2S → 3S↓ + 2H2O
f) 2K + 2H2O →2KOH + H2
ZnCl2 + 2KOH → Zn(OH)2↓ + 2KCl
Zn(OH)2 + 2KOH dư → K2ZnO2 + 2H2O
g) 2H3PO4 + 3Ca(OH)2 dư → Ca3(PO4)2↓ + 6H2O
Câu 27. B
W có nhiệt độ nóng chảy cao nhất, được sử dụng làm dây tóc bóng đèn.
Câu 28. B
2Na + 2H2O → 2NaOH + H2 (H2O trong dung dịch)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2.
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Câu 29. C
Nước cứng là nước chứa nhiều ion Ca2+, Mg2+.
Câu 30. B
Các nhận xét đúng là: b, d, e, g.
a) sai vì các kim loại Na, K… tác dụng với H2O có trong dung dịch trước.
c) Tráng Sn lên sắt để sắt không bị ăn mòn là phương pháp bảo vệ kim loại bằng phương pháp che phủ bề mặt.
f) sai vì môi trường của muối còn phụ thuộc vào gốc axit.
Nguồn: /
Tags : Đề thi Giữa học kì 2 Hóa Học 12 Đề 1