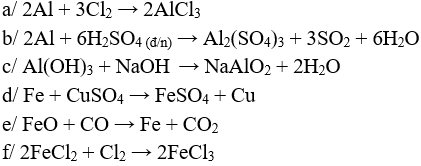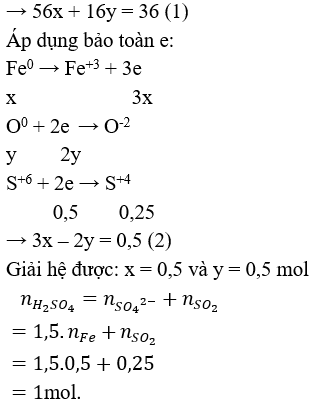Đề thi Giữa học kì 2, Môn: Hóa Học 12, Trắc nhiệm, Tự luận, (Đề 6)
Cập nhật: 14/12/2022
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 6)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, K = 39, Al = 27, Fe = 56, Cu = 64.
I. Phần trắc nghiệm
Câu 1: X3+ có cấu hình electron là: 1s22s22p63s23p63d5. Cấu hình electron của X2+ là
A. 1s22s22p63s23p64s23d3.
B. 1s22s22p63s23p63d5.
C. 1s22s22p63s23p63d6.
D. 1s22s22p63s23p63d64s2.
Câu 2: Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3. Hiện tượng quan sát được là
A. có kết tủa keo trắng tan dần đến hết.
B. có kết tủa keo trắng, không thấy kết tủa tan.
C. có kết tủa keo trắng rồi tan, sau đó lại có kết tủa.
D. dung dịch trong suốt.
Câu 3: Trong quá trình điện phân nóng chảy Al2O3 để sản xuất Al, criolit (3NaF, AlF3) có tác dụng
(1) Tạo hỗn hợp dẫn điện tốt hơn
(2) Hạ nhiệt độ nóng chảy Al2O3
(3) Hạn chế Al sinh ra bị oxi hóa bởi không khí
Số tác dụng đúng là
A. 0.
B. 1.
C. 2.
D. 3.
Câu 4: Hoà tan Fe vào dd AgNO3 dư, dung dịch thu được chứa chất nào sau đây?
A. Fe(NO3)2.
B. Fe(NO3)3.
C. Fe(NO2)2, Fe(NO3)3, AgNO3.
D. Fe(NO3)3, AgNO3.
Câu 5: Hợp chất không có tính lưỡng tính?
A. Al(OH)3.
B. Al2O3.
C. Al2(SO4)3.
D. NaHCO3.
Câu 6: Cho vào dung dịch AlCl3 một lượng Na từ từ đến dư. Sau phản ứng có hiện tượng là
A. Na tan dần, Al kết tủa.
B. Na tan dần, có khí thoát ra và kết tủa xuất hiện.
C. Na tan dần, có khí thoát ra và kết tủa xuất hiện, sau đó kết tủa tan dần.
D. Na tan dần, dung dịch trong suốt rồi lại có kết tủa.
Câu 7: Cho hỗn hợp X gồm Mg và Fe vào dung dịch axit H2SO4 đặc, nóng đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và một phần Fe không tan. Chất tan có trong dung dịch Y là
A. MgSO4 và FeSO4.
B. MgSO4.
C. MgSO4 và Fe2(SO4)3.
D. MgSO4, Fe2(SO4)3 và FeSO4.
Câu 8: Các thí nghiệm sau:
1. Cho dung dịch AlCl3 tác dụng với dung dịch NH3 dư.
2. Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
3. Cho dung dịch HCl dư vào dung dịch NaAlO2.
4. Dẫn khí CO2 dư vào dung dịch NaAlO2.
Số thí nghiệm không thu được kết tủa là
A. 0.
B. 2.
C. 1.
D. 3.
Câu 9: Quặng giàu sắt nhất trong tự nhiên nhưng hiếm là
A. Hematit.
B. Xiđehit.
C. Manhetit.
D. Pirit.
Câu 10: Để điều chế Fe(NO3)2 ta có thể dùng phản ứng nào sau đây?
A. Fe + HNO3.
B. Dung dịch Fe(NO3)3 + Fe.
C. FeO + HNO3.
D. FeS + HNO3.
II. Phần tự luận
Câu 1 (3 điểm): Viết các PTHH xảy ra trong các trường hợp sau:
a/ Al tác dụng với Cl2
b/ Al tác dụng với H2SO4 đặc, nóng e/ FeO tác dụng với CO
c/ NaOH tác dụng với Al(OH)3
d/ Fe tác dụng với CuSO4
f/ Sục Cl2 vào FeCl2
Câu 2 (2 điểm): Chia hỗn hợp X gồm K, Al và Fe thành hai phần bằng nhau.
- Cho phần 1 vào dung dịch KOH (dư) thu được 0,784 lít khí H2 (đktc).
- Cho phần 2 vào một lượng dư H2O, thu được 0,448 lít khí H2 (đktc) và m gam hỗn hợp kim loại Y. Hoà tan hoàn toàn Y vào dung dịch HCl (dư) thu được 0,56 lít khí H2 (đktc). Tính khối lượng mỗi kim loại trong mỗi phần.
Câu 3 (2 điểm): Cho 36 gam hỗn hợp Fe, FeO, Fe3O4 tác dụng hoàn toàn với dung dịch H2SO4 đặc, nóng dư thấy thoát ra 5,6 lít khí SO2 ở đktc (sản phẩm khử duy nhất).Tính số mol H2SO4 đã phản ứng.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | C | B | D | D | C | C | A | B | C | B |
Câu 1: Cấu hình electron của X2+ là 1s22s22p63s23p63d6. Chọn đáp án C.
Câu 2: AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl. Chọn đáp án B.
Câu 3: Trong quá trình điện phân nóng chảy Al2O3 để sản xuất Al, criolit (3NaF, AlF3) có tác dụng
(1) Tạo hỗn hợp dẫn điện tốt hơn
(2) Hạ nhiệt độ nóng chảy Al2O3
(3) Hạn chế Al sinh ra bị oxi hóa bởi không khí. Chọn đáp án D.
Câu 4: Fe + 2Ag+ → Fe2+ + 2Ag
Fe2+ + Ag+ → Fe3+ + Ag
Dung dịch sau phản ứng gồm: Fe(NO3)3 và AgNO3 dư. Chọn đáp án D.
Câu 5: Al2(SO4)3 không có tính lưỡng tính. Chọn đáp án C.
Câu 6: 2Na + 2H2O → 2NaOH + H2↑
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH dư → NaAlO2 + H2O
Chọn đáp án C.
Câu 7: Sau phản ứng còn Fe dư, chất tan có trong dung dịch Y là MgSO4 và FeSO4. Chọn đáp án A.
Câu 8: Thí nghiệm không thu được kết tủa là:
2. Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
3. Cho dung dịch HCl dư vào dung dịch NaAlO2.
Chọn đáp án B.
Câu 9: Quặng giàu sắt nhất trong tự nhiên nhưng hiếm là manhetit. Chọn đáp án C.
Câu 10: Fe + 2Fe(NO3)3 → 3Fe(NO3)2. Chọn đáp án B.
2. Phần tự luận
Câu 1 (3 điểm): HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT.
Câu 2 (2 điểm): Gọi số mol K, Al, Fe trong mỗi phần lần lượt là x, y, z (mol)
Câu 3 (2 điểm): Quy đổi hỗn hợp: Fe, FeO, Fe3O4 thành Fe (x mol) và O ( y mol)
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Nguồn: /