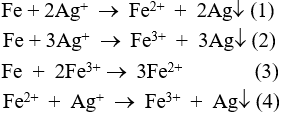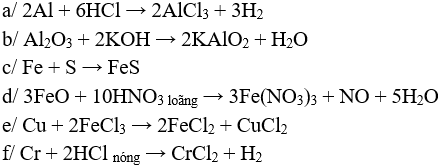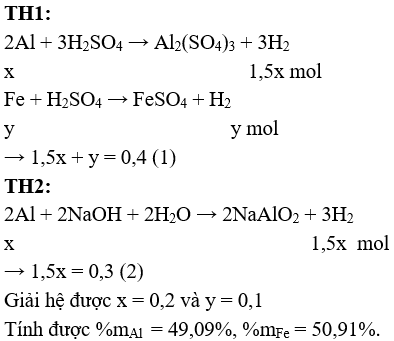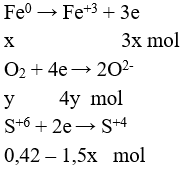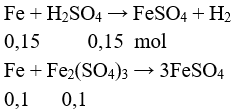Đề thi Giữa học kì 2, Môn: Hóa Học 12, Trắc nhiệm, Tự luận, (Đề 8)
Cập nhật: 14/12/2022
Đề thi Giữa học kì 2
Môn: Hóa Học 12
Thời gian làm bài: 45 phút
(Đề 4)
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Al = 27, Fe = 56, Cr = 52.
I. Phần trắc nghiệm
Câu 1: Tìm câu phát biểu đúng?
A. Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) vừa có tính khử và tính oxi hoá.
B. Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) chỉ có tính oxi hoá .
C. Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) chỉ có tính khử.
D. Fe chỉ có tính oxi hoá, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) chỉ có tính khử.
Câu 2: Nhận định nào sau đây sai về Al?
A. Al có tính khử mạnh nhưng yếu hơn Na và Mg.
B. Al thuộc chu kì 3, nhóm IIIA, ô số 13 trong bảng tuần hoàn.
C. Al dẫn điện, dẫn nhiệt tốt, tốt hơn các kim loại Ag và Cu.
D. Al dễ nhường 3 electron hoá trị nên thường có số oxi hoá +3 trong các hợp chất.
Câu 3: Khi cho nhôm tác dụng với dung dịch HNO3 loãng chỉ tạo ra sản phẩm khử là NH4NO3. Tổng các hệ số là số nguyên tối giản nhất trong phương trình hoá học của phản ứng xảy ra là
A. 74.
B. 58.
C. 76.
D. 68.
Câu 4: Khi cho bột sắt dư vào ddAgNO3, hãy cho biết có những phản ứng nào sau đây xảy ra?
A. Đáp án khác.
B. (1).
C. (1) (4) và (3).
D. (2) và (3).
Câu 5: Thứ tự một số cặp oxi hoá - khử trong dãy điện hoá như sau: Mg2+/Mg; Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag. Dãy chỉ gồm các chất, ion tác dụng được với ion Fe3+ trong dung dịch là
A. Fe, Cu, Ag+.
B. Mg, Fe2+, Ag.
C. Mg, Cu, Cu2+.
D. Mg, Fe, Cu.
Câu 6: Tính chất vật lí nào sau đây không phải là tính chất vật lí của sắt?
A. Có tính nhiễm từ.
B. Màu trắng xám, dẻo, dễ rèn.
C. Dẫn điện và dẫn nhiệt tốt.
D. Kim loại nặng, khó nóng chảy.
Câu 7: Cho 6,72 gam Fe vào 400 ml dung dịch HNO3 1M, đến khi phản ứng xảy ra hoàn toàn, thu được khí NO (sản phẩm khử duy nhất) và dung dịch X. Dung dịch X có thể hoà tan tối đa m gam Cu. Giá trị của m là
A. 0,64.
B. 3,20.
C. 1,92.
D. 3,84.
Câu 8: Cho 9g hợp kim Al tác dụng với dung dịch NaOH đặc, nóng, dư thu được 10,08 lít H2 (đktc). % Al trong hợp kim là
A. 90%.
B. 9%.
C. 7,3%.
D. 73%.
Câu 9: Dãy chất nào sau đây phản ứng với cả 2 dung dịch HCl và KOH?
A. Cr2O3, ZnO, Cr(OH)3.
B. ZnO, CrO3, Cr(OH)2.
C. ZnO, CrO3, Cr(OH)3.
D. ZnO, Cr2O3, Cr(OH)2.
Câu 10: Khối lượng K2Cr2O7 tác dụng vừa đủ với 0,6 mol FeSO4 trong môi trường H2SO4 loãng là
v
A. 28,4 gam.
B. 29,4 gam.
C. 27,4 gam.
D. 26,4 gam.
II. Phần tự luận
Câu 1 (3 điểm): Viết các PTHH xảy ra trong các trường hợp sau:
a/ Al tác dụng với HCl
b/ Al2O3 tác dụng với KOH
c/ Fe tác dụng với lưu huỳnh
d/ FeO tác dụng với HNO3 loãng
e/ Nhúng dây đồng vào dd FeCl3
f/ Cr tác dụng với HCl nóng
Câu 2 (2 điểm): Cho một lượng hỗn hợp Al, Fe tác dụng với dung dịch H2SO4 loãng, dư thấy thu được 8,96 lít khí ở đktc. Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít khí H2 ở đktc. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Câu 3 (2 điểm): Nung m gam Fe trong bình kín chứa V lít không khí (ở đktc; %V của N2 = 80% còn lại là O2) đến khi oxi phản ứng hết thu được 14,08 gam chất rắn X gồm: Fe và 3 oxit của Fe. Hòa tan toàn bộ X bằng một lượng vừa đủ 42 gam dung dịch H2SO4 98% thu được dung dịch Y (sản phẩm khử duy nhất của S+6 là S+4).
a/ Xác định m, V.
b/ Cho 150 ml H2SO4 1M vào Y thu được dung dịch Z. Z hòa tan tối đa a gam Fe. Xác định a.
Đáp án & Thang điểm
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đ/a | A | C | B | B | D | D | C | A | A | B |
Câu 1: Phát biểu đúng : Fe chỉ có tính khử, hợp chất sắt (III) chỉ có tính oxi hoá, hợp chất sắt (II) vừa có tính khử và tính oxi hoá. Chọn đáp án A.
Câu 2: Nhận định sai về Al: Al dẫn điện, dẫn nhiệt tốt, tốt hơn các kim loại Ag và Cu.Chọn đáp án C.
Câu 3: 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Tổng các hệ số là số nguyên tối giản nhất trong phương trình hoá học là 58. Chọn đáp án B.
Câu 4: Khi cho bột sắt dư vào ddAgNO3, phản ứng xảy ra: 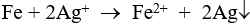
Câu 5: Mg, Fe, Cu tác dụng được với ion Fe3+ trong dung dịch. Chọn đáp án D.
Câu 6: Tính chất vật lí không phải là tính chất vật lí của sắt: “Kim loại nặng, khó nóng chảy”. Chọn đáp án D.
Câu 7:

→ mCu bị hòa tan là 0,03 x 64 = 1,92 g. Chọn đáp án C.
Câu 8: Bảo toàn e có nAl = 0,3 mol → mAl = 0,3.27 = 8,1g.
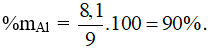
Câu 9: Cr2O3, ZnO, Cr(OH)3 phản ứng với cả 2 dung dịch HCl và KOH. Chọn đáp án A.
Câu 10: Bảo toàn e tính được nK2Cr2O7 = 0,1 mol → m = 0,1. 294 = 29,4 gam. Chọn đáp án B.
2. Phần tự luận
Câu 1 (3 điểm): HS viết đúng mỗi PTHH 0,5 điểm, thiếu cân bằng trừ ½ số điểm mỗi PT.
Câu 2 (2 điểm): Gọi số mol Al và Fe trong hỗn hợp lần lượt là x và y (mol)
Câu 3 (2 điểm): a/ Qui đổi hỗn hợp X thành: Fe và O2 với số mol lần lượt là x và y mol
Ta có các quá trình:
Tính số mol H2SO4 = 0,42 mol
Áp dụng định luật bảo toàn e được:
3x = 4y + 2.(0,42 - 1,5x) (I)
Theo bài ra ta có: 56x + 32y = 14,08 (II)
Giải hệ: x = 0,2; y = 0,09
Vậy m = 0,2.56= 11,2 gam; V = 0,09.5.22,4 = 10,08 lít
b/ Z gồm: H2SO4 0,15 mol và Fe2(SO4)3 0,1 mol
Tính được a = 0,25.56 = 14 gam.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Nguồn: /