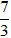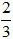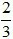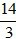Đề thi Học kì 1, Môn: Hóa Học lớp 11, Có ma trận, (Đề 4)
Cập nhật: 14/12/2022
MA TRẬN ĐỀ KIỂM TRA HỌC KỲ I - NĂM HỌC 2022 - 2023
MÔN HÓA: 11
(Trắc nghiệm 30 câu ×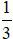 điểm = 10,0 điểm)
điểm = 10,0 điểm)
|
Chủ đề |
CẤP ĐỘ |
||
|
Nhận biết |
Thông hiểu |
Vận dụng |
|
|
1. Sự điện li |
- Biết chất điện li mạnh, yếu. - Biết được axit, bazơ, muối, hiđroxit lưỡng tính. - Biết được môi trường theo pH. |
- Hiểu bản chất, điều kiện xảy ra phản ứng trao đổi ion trong dung dịch chất điện li. |
- Tính pH của dung dịch. - Viết được phương trình ion thu gọn. - Giải một số bài tập theo phương pháp bảo toàn điện tích. |
|
Số câu: 10 Số điểm: Tỉ lệ%: 33,33% |
Số câu: 5 Số điểm: Tỉ lệ: 16,67% |
Số câu: 2 Số điểm: Tỉ lệ: 6,67% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
|
2. Nitơ - photpho |
- Biết tính chất hóa học, ứng dựng, điều chế nitơ. - Biết tính chất hóa học của amoniac, muối amoni. - Phương pháp điều chế N2, NH3, HNO3. - Biết tính chất hóa học của P và H3PO4. - Biết vai trò các loại phân bón và biết một số loại phân bón cơ bản. |
- Hiểu được tính chất hóa học của axit HNO3, tính chất của các muối nitrat. - Biết được cách tính độ dinh dưỡng của phân bón. |
Giải bài tập bảo toàn electron khi cho kim loại tác dụng với HNO3. - Giải bài tập khi cho dung dịch kiềm như NaOH, KOH tác dụng với H3PO4. - Giải một số bài tập tìm kim loại hoặc xác định sản phẩm khử của nitơ. - Giải bài tập về tổng hợp NH3. |
|
Số câu: 10 Số điểm: Tỉ lệ%: 33,33% |
Số câu: 4 Số điểm: Tỉ lệ: 13,33% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
|
3. Cacbon và hợp chất của các bon |
Biết được tính chất hóa học và ứng dụng của cacbon và một số hợp chất hay gặp. |
|
- Giải bài tập về CO khử oxit kim loại. - Giải bài tập về muối cacbanat |
|
Số câu: 3 Số điểm: 1 Tỉ lệ%: 10% |
Số câu: 2 Số điểm: Tỉ lê: 6,67% |
|
Số câu: 1 Số điểm: Tỉ lê: 3,33% |
|
4. Đại cương hóa học hữu cơ |
- Biết một số đặc điểm của hợp chất hữu cơ. - Biết cách phân loại hợp chất hữu cơ. - Nắm được khái niệm công thức phân tử, công thức đơn giản nhất. |
- Hiểu được đồng đẳng, đồng phân. - Biết cách viết công thức cấu tạo. |
- Giải bài tập xác định công thức phân tử theo % khối lượng và từ công thức đơn giản nhất. - Vận dụng phương pháp bảo toàn nguyên tố, bảo toàn khối lượng giải bài tập đốt cháy hợp chất hữu cơ. |
|
Số câu: 7 Số điểm: Tỉ lệ%: 23,33% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
Số câu: 2 Số điểm: Tỉ lệ: 6,67% |
Số câu: 2 Số điểm: Tỉ lệ: 6,67% |
|
Tổng số câu: 30 Tổng số điểm: 10 Tỉ lệ% = 100% |
Số câu: 14 Số điểm: Tỉ lệ: 46,67% |
Số câu: 7 Số điểm: Tỉ lệ: 23,33% |
Số câu: 9 Số điểm: 3 Tỉ lệ: 30% |
ĐỀ THEO MA TRẬN
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Hợp chất nào sau đây có tính lưỡng tính?
A. Al(OH)3. B. Ba(OH)2. C. Fe(OH)2. D. Cr(OH)2.
Câu 2: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion SO42- trong X là
A. 0,2M. B. 0,8M. C. 0,6M. D. 0,4M.
Câu 3: Trộn 200 ml dung dịch gồm HCl 0,1M vá H2SO4 0,15M với 300 ml dung dịch Ba(OH)2 nồng độ aM, thu được m gam kết tủa và 500 ml dung dịch có pH = 1. Giá trị của a và m lần lượt là
A. 0,15 và 2,330. B. 0,10 và 6,990.
C.0,10 và 4,660. D. 0.05 và 3,495.
Câu 4: Cho 10 ml dung dịch X chứa HCl 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần đẻ trung hòa dung dịch X là:
A. 10 ml. B. 15 ml. C. 20 ml. D. 25 ml.
Câu 5: Phương trình điện li nào sau đây viết đúng?
A. H2SO4⇄ H+ + HSO4- B. H2CO3⇄ 2H+ + HCO3-
C. H2SO3 → 2H+ + SO32- D. Na2S ⇄ 2Na+ + S2-
Câu 6: Axit nào sau đây là axit một nấc?
A. H2SO4 B. H2CO3 C. CH3COOH D. H3PO4
Câu 7: A là dung dịch HNO3 0,01M; B là dung dịch H2SO4 0,005M. Trộn các thể tích bằng nhau của A và B được dung dịch X. Tính pH của dung dịch X
A. 1 B. 2 C. 3 D. 4
Câu 8: Phương trình: S2-+ 2H+ → H2S là phương trình ion rút gọn của phản ứng nào?
A. FeS + 2HCl → FeCl2 + H2S↑.
B. 2NaHSO4 + 2Na2S → 2Na2SO4 + H2S↑
C. 2HCl + K2S → 2KCl + H2S↑.
D. BaS + H2SO4 → BaSO4↓ + H2S↑.
Câu 9: Cho các dung dịch axit có cùng nồng độ mol: H2S, HCl, H2SO4, H3PO4, dung dịch có nồng độ H+ lớn nhất là:
A. H2SO4 B. H2S C. HCl D. H3PO4
Câu 10: Cho 4 dung dịch trong suốt, mỗi dung dịch chỉ chứa một loại cation và một loại anion trong các ion sau: Ba2+, Al3+, Na+, Ag+, CO32-, NO3-, Cl-, SO42-. Các dung dịch đó là:
A. BaCl2, Al2(SO4)3, Na2CO3, AgNO3.
B. Ba(NO3)2, Al2(SO4)3, Na2CO3, AgCl.
C. BaCl2, Al2(SO4)3, Na2CO3, AgNO3.
D. Ba(NO3)2, Al2(SO4)3, NaCl, Ag2CO3.
Câu 11: Trong công nghiệp, N2 được tạo ra bằng cách nào sau đây?
A. Nhiệt phân muối NH4NO3 đến khối lượng không đổi.
B. Chưng cất phân đoạn không khí lỏng.
C. Phân hủy NH3.
D. Đun nóng Mg với dung dịch HNO3 loãng.
Câu 12: Tìm phản ứng viết sai:
A. NH4NO3 −to→ NH3 + HNO3
B. (NH4)2CO3 −to→ 2NH3 + CO2 + H2O
C. NH4Cl −to→ NH3 + HCl
D. NH4HCO3 −to→ NH3 + CO2 + H2O
Câu 13: Cho những cặp chất sau: (1) C và CO, (2) CO2 và dung dịch Ba(OH)2, (3) CO và CaO, (4) CO2 và Al. Các cặp chất không có phản ứng xảy ra là:
A. (1) và (3). B. (2) và (3). C. (3) và (4). D. (1) và (2).
Câu 14: Loại phân đạm nào sau đây có độ dinh dưỡng cao nhất?
A. (NH4)2SO4. B. (NH2)2CO. C. NH4NO3. D. NH4Cl.
Câu 15: Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng trong dung dịch chứa:
A. KH2PO4 và K3PO4. B. K2HPO4 và K3PO4.
C. KH2PO4 và K2HPO4. D. K3PO4 và KOH dư.
Câu 16: Cho các chất KNO3, Fe(NO3)3, Zn(NO3)2, Fe(NO3)2. Số chất khi bị nhiệt phân thu được hỗn hợp khí NO2, O2 là:
A. 4. B. 3 C. 2 D. 1
Câu 17: Điều khẳng định nào sau đây đúng khi nói về tính chất hóa học của NH3. NH3 có:
A. tính oxi hoá B. tính khử và tính bazơ yếu
C. tính khử D. tính bazơ yếu
Câu 18: Hòa tan hỗn hợp gồm 0,1 mol Al và 0,2 mol Zn bằng 500 ml dung dịch HNO3 vừa đủ, thu được dung dịch A và không thấy khí thoát ra. Cô cạn dung dịch A thu m gam muối. Giá trị của m là:
A. 51,9 gam B. 66,1 gam
C. 59,1 gam D. 61,6 gam
Câu 19: Tìm phương trình hóa học viết sai?
A. 2P + 3Ca −to→ Ca3P2 B. 4P + 5O2 (dư) −to→ 2P2O5
C. PCl3 + 3H2O → H3PO3 + 3HCl D. P2O3 + 3H2O → 2H3PO4
Câu 20: Kim loại Cu tan trong dung dịch axit HNO3 nhận thấy thoát ra khí X có màu nâu đỏ, là sản phẩm khử duy nhất. Vậy X là
A. NO. B. NO2. C. N2. D. N2O.
Câu 21: Tính bazơ của NH3 do:
A. Trên nitơ còn cặp e tự do.
B. Phân tử có 3 liên kết cộng hóa trị phân cực.
C. NH3 tan được nhiều trong H2O.
D. NH3 tác dụng với H2O tạo NH4OH.
Câu 22: Nung hoàn toàn 10 gam CaCO3 ở 10000C thu được V lít khí CO2 thoát ra ở đktc. Giá trị của V là:
A. 2,24 lít. B. 1,12 lít. C. 0,112 lít. D. 4,48 lít.
Câu 23: Tính oxi hóa của cacbon thể hiện ở phản ứng
A. C + O2 −to→ CO2. B. C + 2CuO −to→ 2Cu + CO2.
C. 3C + 4Al −to→ Al4C3. D. C + H2O −to→ CO + H2.
Câu 24: Hợp chất hữu cơ được phân loại như sau:
A. Hiđrocacbon và hợp chất hữu cơ có nhóm chức.
B. Hiđrocacbon và dẫn xuất của hiđrocacbon.
C. Hiđrocacbon no, không no, thơm và dẫn xuất của hiđrocacbon.
D. Tất cả đều đúng.
Câu 25: Chất nào sau đây là dẫn xuất của hiđrocacbon?
A. CH4 B. C2H6 C. C6H6 D. C3H6Br.
Câu 26: Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X (C, H, O), thu được 8,96 lít CO2 (đktc) và 7,2 gam H2O. Biết tỉ khối của X so với CO2 là 2. Công thức phân tử của X là:
A. C2H4O B. C5H12O C. C4H8O2 D. C3H4O3.
Câu 27: Phản ứng hóa học của các chất hữu cơ thường:
A. xảy ra nhanh và tạo ra hỗn hợp sản phẩm.
B. xảy ra chậm và tạo ra một sản phẩm duy nhất.
C. xảy ra chậm và tạo ra hỗn hợp sản phẩm.
D. xảy ra nhanh và tạo ra một sản phẩm duy nhất.
Câu 28: Khi phân tích một hợp chất hữu cơ (X) có thành phần như sau: %C = 52,17%; %H = 13,04% và %O = 34,78%. Biết công thức đơn giản nhất trùng với công thức phân tử. Công thức phân tử của (X) là:
A. C2H6O. B. C3H8O. C. CH4O. D. C4H10O.
Câu 29: Trong những dãy chất sau đây, dãy nào có các chất là đồng phân của nhau?
A. C2H5OH, CH3OCH3. B. CH3OCH3, CH3CHO.
C. CH3CH2CH2OH, C2H5OH. D. C4H10, C6H6.
Câu 30: Số công thức cấu tạo có thể có ứng với các công thức phân tử C4H10 là:
A. 1 B. 2 C. 3 D. 4.
Nguồn: /