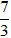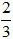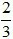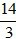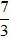Đề thi Học kì 1, Môn: Hóa Học lớp 11, Có ma trận, (Đề 5)
Cập nhật: 14/12/2022
MA TRẬN ĐỀ KIỂM TRA HỌC KỲ I - NĂM HỌC 2022 - 2023
MÔN HÓA: 11
(Trắc nghiệm 30 câu ×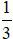 điểm = 10,0 điểm)
điểm = 10,0 điểm)
|
Chủ đề |
CẤP ĐỘ |
||
|
Nhận biết |
Thông hiểu |
Vận dụng |
|
|
1. Sự điện li |
- Biết chất điện li mạnh, yếu. - Biết được axit, bazơ, muối, hiđroxit lưỡng tính. - Biết được môi trường theo pH. |
- Hiểu bản chất, điều kiện xảy ra phản ứng trao đổi ion trong dung dịch chất điện li. |
- Tính pH của dung dịch. - Viết được phương trình ion thu gọn. - Giải một số bài tập theo phương pháp bảo toàn điện tích. |
|
Số câu: 10 Số điểm: Tỉ lệ%: 33,33% |
Số câu: 5 Số điểm: Tỉ lệ: 16,67% |
Số câu: 2 Số điểm: Tỉ lệ: 6,67% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
|
2. Nitơ - photpho |
- Biết tính chất hóa học, ứng dựng, điều chế nitơ. - Biết tính chất hóa học của amoniac, muối amoni. - Phương pháp điều chế N2, NH3, HNO3. - Biết tính chất hóa học của P và H3PO4. - Biết vai trò các loại phân bón và biết một số loại phân bón cơ bản. |
- Hiểu được tính chất hóa học của axit HNO3, tính chất của các muối nitrat. - Biết được cách tính độ dinh dưỡng của phân bón. |
Giải bài tập bảo toàn electron khi cho kim loại tác dụng với HNO3. - Giải bài tập khi cho dung dịch kiềm như NaOH, KOH tác dụng với H3PO4. - Giải một số bài tập tìm kim loại hoặc xác định sản phẩm khử của nitơ. - Giải bài tập về tổng hợp NH3. |
|
Số câu: 10 Số điểm: Tỉ lệ%: 33,33% |
Số câu: 4 Số điểm: Tỉ lệ: 13,33% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
|
3. Cacbon và hợp chất của các bon |
Biết được tính chất hóa học và ứng dụng của cacbon và một số hợp chất hay gặp. |
|
- Giải bài tập về CO khử oxit kim loại. - Giải bài tập về muối cacbanat |
|
Số câu: 3 Số điểm: 1 Tỉ lệ%: 10% |
Số câu: 2 Số điểm: Tỉ lê: 6,67% |
|
Số câu: 1 Số điểm: Tỉ lê: 3,33% |
|
4. Đại cương hóa học hữu cơ |
- Biết một số đặc điểm của hợp chất hữu cơ. - Biết cách phân loại hợp chất hữu cơ. - Nắm được khái niệm công thức phân tử, công thức đơn giản nhất. |
- Hiểu được đồng đẳng, đồng phân. - Biết cách viết công thức cấu tạo. |
- Giải bài tập xác định công thức phân tử theo % khối lượng và từ công thức đơn giản nhất. - Vận dụng phương pháp bảo toàn nguyên tố, bảo toàn khối lượng giải bài tập đốt cháy hợp chất hữu cơ. |
|
Số câu: 7 Số điểm: Tỉ lệ%: 23,33% |
Số câu: 3 Số điểm: 1 Tỉ lệ: 10% |
Số câu: 2 Số điểm: Tỉ lệ: 6,67% |
Số câu: 2 Số điểm: Tỉ lệ: 6,67% |
|
Tổng số câu: 30 Tổng số điểm: 10 Tỉ lệ% = 100% |
Số câu: 14 Số điểm: Tỉ lệ: 46,67% |
Số câu: 7 Số điểm: Tỉ lệ: 23,33% |
Số câu: 9 Số điểm: 3 Tỉ lệ: 30% |
ĐỀ THEO MA TRẬN
Đề thi Học kì 1
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 11
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 5)
(Cho H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; K = 39; Cl = 35,5; Ca = 40; P= 31; S = 32; Fe = 56; Cu = 64; Zn = 65; Ag = 108; Ba = 137)
Câu 1: Có 4 dung dịch: Natri clorua, rượu etylic, axit axetic, kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
A. NaCl < C2H5OH < CH3COOH < K2SO4.
B. C2H5OH < CH3COOH < NaCl < K2SO4.
C. C2H5OH < CH3COOH < K2SO4 < NaCl.
D. CH3COOH < NaCl < C2H5OH < K2SO4.
Câu 2: Trộn 400 ml dung dịch Fe2(SO4)3 0,2M với 100 ml dung dịch FeCl3 0,3M thu được dung dịch Y. Nồng độ ion Fe3+ trong Y là:
A. 0,38M. B. 0,22M. C. 0,19M. D. 0,11M.
Câu 3: Dãy chất nào sau đây chỉ gồm các hiđroxit lưỡng tính?
A. Al(OH)3, Zn(OH)3, Fe(OH)2. B. Zn(OH)2, Sn(OH)2, Pb(OH)2.
C. Al(OH)3, Fe(OH)2, Mg(OH)2. D. Mg(OH), Pb(OH)2, Fe(OH)2.
Câu 4: Theo thuyết Areniut kết luận nào sau đây không đúng?
A. Muối là những hợp chất khi tan trong nước chỉ phân li ra cation kim loại và anion gốc axit.
B. Muối axit là muối mà anion gốc axit vẫn còn hiđrô có khả năng phân li ra ion H+.
C. Muối trung hòa là muối mà anion gốc axit không còn hiđrô có khả năng phân li ra H+.
D. Hiđroxit lưỡng tính khi tan vào nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
Câu 5: Cho 300 ml dung dịch chứa H2SO4 0,1M, HNO3 0,2M và HCl 0,3M tác dụng với V ml dung dịch NaOH 0,2 M và KOH 0,29M thu được dung dịch có pH = 2. Giá trị của V là:
A. 134. B. 147. C. 114. D. 169.
Câu 6: Khi hòa tan trong nước, chất nào sau đây làm cho quỳ tím chuyển màu xanh?
A. NaCl. B. NH4Cl. C. Na2CO3. D. FeCl3.
Câu 7: Hòa tan 4,9 gam H2SO4 vào nước thu được 1 lít dung dịch. pH của dung dịch thu được là:
A. 1 B. 2 C. 3 D. 4
Câu 8: Các ion nào sau không thể cùng tồn tại trong một dung dịch
A. Na+, Mg2+, NO3-, SO42-. B. Ba2+, Al3+, Cl-, HSO4-.
C. Cu2+, Fe3+, SO42-, Cl-. D. K+, NH4+, OH-, PO43-.
Câu 9: Phương trình ion rút gọn: H+ + HCO3-→ CO2 ↑ + H2O
Tương ứng với phương trình hóa học dạng phân tử nào sau đây?
(1) 2HCl + Na2CO3 → 2 NaCl + CO2 ↑ + H2O
(2) 2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 ↑ + 2H2O
(3) CaCO3 + 2HCl → CaCl2 + CO2 ↑ + H2O
(4) Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 ↑ + 2H2O
A. 1, 2 B. 2, 3 C. 2, 4 D. 1, 3
Câu 10: Cho các chất sau: HCl, HNO3, NaOH, Ba(OH)2, CH3COOH, K2SO4, Na3PO4, HF, Al2(SO4)3, H2SO3, H3PO4. Số chất điện li yếu là:
A. 2 B. 3 C. 4 D. 5
Câu 11: Cho các phản ứng sau:
(1) N2 + O2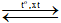 2NO
2NO
(2) N2 + 3H2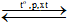 2NH3.
2NH3.
Trong hai phản ứng trên thì nitơ:
A. chỉ thể hiện tính oxi hóa.
B. chỉ thể hiện tính khử.
C. thể hiện tính khử và tính oxi hóa.
D. không thể hiện tính khử và tính oxi hóa.
Câu 12: Cho 100 gam dung dịch NH4HSO4 có nồng độ 11,5% vào 100 gam dung dịch Ba(OH)2 có nồng độ 13,68% và đun nhẹ. Thể tích khí (đktc) và khối lượng kết tủa thu được là (giả sử toàn bộ khí sinh ra thoát ra khỏi dung dịch)
A. 2,24 lít và 23,3 gam B. 2,244 lít và 18,64 gam
C. 1,344 lít và 18,64 gam D. 1,792 lít và 18,64 gam.
Câu 14: Trong phòng thí nghiệm, người ta điều chế HNO3 từ
A. NH3 và O2. B. NaNO2 và H2SO4 đặc.
C. NaNO3 và H2SO4 đặc. D. NaNO2 và HCl đặc.
Câu 15: Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa?
A. ZnS + HNO3 (đặc, nóng) B. Fe2O3 + HNO3(đặc, nóng)
C. FeSO4 + HNO3 (loãng) D. Cu + HNO3 (đặc, nóng)
Câu 16: Chia 20 gam hỗn hợp gồm Mg, Al, Zn thành hai phần bằng nhau. Đốt cháy hoàn toàn phần một trong O2 dư thu được 21 gam hỗn hợp oxit. Phần hai hòa tan trong dung dịch HNO3 đặc, nóng dư thu được V (lít) NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của V là:
A. 44,8. B. 89,6. C. 22,4. D. 30,8.
Câu 17: Thêm 0,15 mol KOH vào dung dịch chứa 0,1 mol H3PO4. Sau phản ứng trong dung dịch chứa:
A. KH2PO4 và K3PO4. B. K2HPO4 và K3PO4.
C. KH2PO4 và K2HPO4. D. K3PO4 và KOH dư.
Câu 18: Ở nhiệt độ cao, khí CO có thể khử được oxit nào sau đây?
A. MgO. B. Fe2O3. C. Al2O3. D. BaO.
Câu 19: Phân lân đều cung cấp cho cây trồng nguyên tố dinh dưỡng là
A. Nitơ. B. Cacbon. C. Photpho. D. Kali.
Câu 20: Đốt cháy một lượng nhỏ photpho đơn chất (P) trong bình chứa khí oxi dư thu được một oxit X. Công thức của X là
A. PO2. B. P2O7. C. P2O5. D. P2O3.
Câu 21: Cho cacbon lần lượt tác dụng với Al, H2O, CuO, HNO3 đặc, H2SO4 đặc, KClO3, CO2 ở điều kiện thích hợp. Số phản ứng mà trong đó cacbon đóng vai trò chất khử là:
A. 6. B. 4. C. 7. D. 5.
Câu 22: Tủ lạnh dùng lâu ngày thường có mùi hôi. Để khử mùi người ta thường cho vào tủ lạnh một mẩu than gỗ. Than gỗ lại có khả năng khử mùi hôi là vì:
A. than gỗ có tính khử mạnh.
B. than gỗ xúc tác cho quá trình chuyển hóa các chất khí có mùi hôi thành chất không mùi.
C. than gỗ có khả năng phản ứng với các khí có mùi tạo thành chất không mùi.
D. than gỗ có khả năng hấp phụ các khí có mùi hôi.
Câu 23: Chất nào sau đây có thể làm khô khí NH3 có lẫn hơi nước?
A. P2O5. B. H2SO4 đặc. C. CuO bột. D. NaOH rắn.
Câu 24: Số công thức tạo mạch hở có thể có ứng với công thức phân tử C4H8 là:
A. 1 B. 2 C. 3 D. 4.
Câu 25: Cặp chất nào sau đây là đồng đẳng của nhau?
A. CH3OH, CH3OCH3. B. CH3OCH3, CH3CHO.
C. CH3OH, C2H5OH. D. CH3CH2OH, C3H6(OH)2.
Câu 26: Chất nào dưới đây là dẫn xuất của hiđrocacbon ?
A. NaCl B. CH2Cl2 C.CH3CH3. D. KBr.
Câu 27:Kết quả phân tích nguyên tố hợp chất X cho biết %mC = 60,0%; %mH = 8,0%, còn lại là oxi. Tỉ khối hơi của X so với CO2 nhỏ hơn 3. Công thức phân tử của X là:
A. C3H8O B. C3H8O2 C. C5H8O2 D. C5H8O.
Câu 28: Thành phần các nguyên tố trong hợp chất hữu cơ:
A. nhất thiết phải có cacbon, thường có H, hay gặp O, N sau đó đến halogen, S, P.
B. gồm có C, H và các nguyên tố khác.
C. bao gồm tất cả các nguyên tố trong bảng tuần hoàn.
D. thường có C, H hay gặp O, N, sau đó đến halogen, S, P.
Câu 29: Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là:
A. thường xảy ra rất nhanh và cho một sản phẩm duy nhất.
B. thường xảy ra chậm, không hoàn toàn, không theo một hướng nhất định.
C. thường xảy ra rất nhanh, không hoàn toàn, không theo một hướng nhất định.
D. thường xảy ra rất chậm, nhưng hoàn toàn, không theo một hướng xác định.
Câu 30: Đốt cháy hoàn toàn 5,8 gam chất hữu cơ X bằng oxi thì thu được 6,72 lít CO2 (đktc) và 5,4 gam H2O. Biết rằng MX = 58. Công thức phân tử của X là
A. C4H10. B. C3H6O. C. C2H4O2. D. C2H2O2.
Nguồn: /