Đề thi thử môn Hóa Lần 1 - Năm 2013 chuyên Khoa học tự nhiên Huế
Cập nhật: 02/07/2020
1.
Hòa tan hỗn hợp X gồm 11,2 gam Fe và 2,4 gam Mg bằng dung dịch H2SO4 loãng (dư), thu được dung dịch Y. Cho dung dịch NaOH dư vào Y thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được m gam chất rắn. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
A:
36
B:
20
C:
18
D:
24
Đáp án: B
m = m Fe2O3 + m MgO = 0,1.160 + 0,1.40 = 20 gam
=> Đáp án B
2.
Cracking một ankan thu được hỗn hợp khí có tỷ khối hơi so với H2 bằng 19,565. Biết hiệu suất của phản ứng Cracking là 84% .CTPT của ankan là :
A:
C3H8
B:
C5H12
C:
C6H14
D:
C4H10
Đáp án: B

3.
Điện phân nóng chảy Al2O3 trong criolit thu được 33,6 m3 hỗn hợp khí X ở đktc và m (kg) Al. Tỉ khối hơi của X so với H2 là 16. Dẫn 2,24 lít X (đktc) vào dung dịch Ca(OH)2 dư thu được 2 gam kết tủa. Giá trị của m là:
A:
25,00
B:
11,75
C:
12,02
D:
12,16.
Đáp án: B
Gọi a, b , c là số mol C5H8O2, C2H4O2 và C7H6O2
số mol CO2 = 5a + 2b + 7c = 0,38
mol H2O = 4a + 2b + 3c = 0,29
số mol rượu = mol metyl metaacrylat = a = 0,01
===> b = 0,095 và c = 0,02
==> CH2=C(CH3)-COONa 0,01 mol, CH3-COONa 0,095 mol và C6H5-COONa
khối lượng muối Na = m = 108*0,01 + 82*0,095 + 144*0,02 = 11,75 ==> câu B
4.
Hỗn hợp X gồm một axit no, đơn chức A và một axit no đa chức B đều có mạch cacbon không phân nhánh. Tỉ khối hơi của X so với hiđro là 43,6. Đốt cháy hoàn toàn 4,36 gam X thu được 7,26 gam CO2. Thành phần phần trăm về khối lượng của A trong hỗn hợp là:
A:
59,40
B:
28,72
C:
40,60
D:
71,28
Đáp án: A
Vì B không phân nhánh ==> B là axit 2 chức
A : CnH2nO2 a mol và B : CmH2m-2O4 b mol
mol hh X = a + b = 0,05
mol CO2 = na + mb = 0,165
khối lượng hh = a(14n + 32) + b(14m + 62) = 4,36 ==> 32a + 62b = 2,05
==> a = 0,035 và b = 0,015
==> 0,035n + 0,015m = 0,165 ==> 7n + 3m = 33 ==> n = 3 và m = 4
==> mA = 74*0,035 = 2,59 ==> %mA = 59,4 ==> câu A
5.
X là hỗn hợp gồm axit cacboxylic đơn chức Y và ancol no Z, đều mạch hởvà có cùng số cacbon trong phân tử. Đốt cháy hoàn toàn 0,1 mol X cần 12,6 gam O2, sau phản ứng thu được 6,72 lít CO2(đktc) và 5,85 gam nước. Este hóa hoàn toàn 0,2 mol X thì khối lượng este tối đa thu được là:
A:
12,50 gam
B:
8,55 gam
C:
10,17 gam
D:
11,50 gam
Đáp án: B
mol hh X = a + b = 0,1 (1)
CnHyO2 + CnH2n+2Oz + O2 ---> CO2 + H2O
a-------------------b---------0,39375--0,3---0,325
mol C = n(a+b) = 0,3
mol H = ay + b(2n+2) = 2*0,325 ===> ay + 8b = 0,65 (2)
mol O = 2a + bz + 2*0,39375 = 2*0,3 + 0,325 ==> 2a + bz = 0,1375 (3)
Nếu z = 1: từ (1) và (3) ==> a = 0,0375 và b = 0,0625 , từ (2) ==> y = 4
Nếu z = 2, hoặc 3 ==> đều loại
C3H4O2 + C3H8O ---> C2H3-COO-C3H7 + H2O
0,0375-------------------------0,0375
khối lượng este = 114*0,0375*2 = 8,55 ===> câu B
6.
Hòa tan hết 12 gam hỗn hợp Fe và Al vào 500ml dung dịch hỗn hợp HNO3 1M và H2SO4 0,8M đun nóng thu được 6,72 lít NO ( đkc, sản phẩm khửduy nhất ) và dung dịch X. Cô cạn X, thu được m gam muối. Giá trị của m là:
A:
56,6
B:
58,0
C:
56,6 ≤ m ≤ 58,0
D:
55,2
Đáp án: C
nNO−3/X=0,5−0,3=0,2
Ta xem Fe Al thành một chất R có hóa trị III và nR=0,3
Trường hợp 1: không còn HNO3⇒nSO2−4/muối=0,3.3−0,22=0,35
m=12+0,2.62+0,35.96=58
Trường hợp 2: không còn H2SO4⇒nNO−3/muối=0,3.3−0,4.2=0,1
m=12+0,4.96+0,1.62=56,6
Vậy 56,6 ≤ m ≤ 58,0
7.
Crackinh hoàn toàn một thểtích ankan X thu được 5 thể tích hỗn hợp Y. Lấy 5,6 lít Y(đkc) làm mất màu vừa đủ dun dịch chứa a mol Br2. Giá trị của a là:
A:
0,2
B:
0,15
C:
0,25
D:
0,1
Đáp án: A
nπ=ntăng
vậy trong 5 mol Y thì có 4 mol π
suy ra trong 0,25 mol Y thì có 0,2 mol π
8.
Hòa tan hết m gam nhôm vào 200 ml dung dịch HCl 3M thu được dung dịch X. Cho X tác dụng với 285 ml dung dịch NaOH 2M thu được 4,68 gam kết tủa. Giá trịcủa m là:
A:
1,89
B:
2,43
C:
1,62
D:
2,16
Đáp án: A
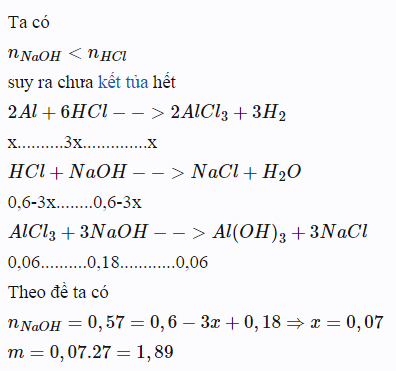
9.
Điện phân nóng chảy Al2O3 trong criolit thu được 33,6 m3 hỗn hợp khí X ởđktc và m (kg) Al. Tỉkhối hơi của X so với H2 là 16. Dẫn 2,24 lít X (đktc) vào dung dịch Ca(OH)2 dư thu được 2 gam kết tủa. Giá trịcủa m là:
A:
27,0
B:
32,4
C:
37,8
D:
48,6
Đáp án: C
* 2.24 lít ứng với nCO2 = 0.02; nhh ứng với 2.24 lít = 0.1
Với a, b là số mol CO, O2
=> 28a + 32b + 0.02*44 = 0.1*16*2 ; a + b + 0.02 = 0.1
=> a = 0.06; b = 0.02
* ĐLBTe : 3nAl = 4nO2 + 2nCO + 4nCO2 = 4*0.02 + 2*0.06 + 4*0.02
=> mAl = 2.52 ứng với nhh = 2.24 lít
* => ứng với 33.6m khối nhân chéo lên => mAl = 2.52 * 33.6*1000 / 2.24 = 37.8
10.
Oxi hóa 1 ancol đơn chức thu được hỗn hợp X gồm 4 chất. Chia X thành 3 phần bằng nhau.
- Phần 1. tác dụng với Na dư thu được 2,8 lít H2(đktc) và dung dịch Y, cô cạn Y được 17 gam chất rắn.
- Phần 2. tác dụng với dung dịch AgNO3/NH3 dư thu được 10,8 gam Ag.
- Phần 3. tác dụng với NaHCO3 dư thu được 1,12 lít CO2(đktc).
Công thức của ancol là:
A:
C2H5OH
B:
C4H9OH
C:
C3H7OH
D:
CH3OH
Đáp án: C
* Gọi số mol :
nancol = x ; naxit = y ; nandehit = z; => nH2O = y + z
x + 2y + z = 2nH2 = 0.25
naxit = y = nCO2 = 0.05
* Giả sử X có CH3OH thì 4z = nAg = 0.1
giải ra x = 0.125; y = 0.05 ; z= 0.025, thử lại không thấy thỏa mãn 17 gam loại
* Giả sử X ko có CH3OH thì 2z = nAg = 0.1
=> x = 0.1; y = z = 0.05
cô cạn dd Y : nRCH2-ONa = x = 0.1 ; nRCOONa = y = 0.05; nNaOH = 0.1
=> 0.1* (R + 14 + 16 + 23) + 0.05* (R + 67) + 0.1*40 = 17 =>R = 29
=> C2H5-CH2-OH : đáp án C
11.
Hòa tan hết 9,1 gam hỗn hợp X gồm Al và Mg, Zn vào 500 ml dung dịch HNO3 4M thu được 0,448 lít N2(đktc) và dung dịch Y. Chia Y thành 2 phần bằng nhau.
- Phần 1: cô cạn thu được m gam chất rắn khan.
- Phần 2: tác dụng vừa đủvới 530ml dung dịch NaOH 2M thu được 2,9 gam kết tủa.
Giá trịcủa m là:
A:
25,76
B:
38,40
C:
33,79
D:
32,48
Đáp án: C
chia đều làm 2 phần
nH+ = 1 ; nN2 = 0.01 ;
khi thêm NaOH thì kết tủa thu được chỉ có Mg(OH)2 =>nMg(OH)2 = 2.9/58 = 0.05
đặt số mol mỗi chất Al, Zn là a và b
27a + 65b = 9.1/2 - 0.05*24
giả sử có NH4NO3 c mol; nếu không có tính sẽ ra số mol là 0
* 12H+ + 2NO3- + 10e --> N2 + H2O
---0.12-----------------------0.01
10H+ + NO3- + 8e -> NH4+ + 3H2O
10d-----------------------c
nH+ dư = 1 - 0.12- 10d = 0.88 - 10c
* Khi thêm OH-
H+ + OH- -->H2O
NH4+ + OH- -->H2O
dư nOH- = 1.06 - ( 0.88 - 10d) - d = 0.18 + 9c
Al3+ + 4OH- --> Al(OH)4- ; Zn2+ + 4OH- -->Zn(OH)42- ; Mg2+ + 2OH- --> Mg(OH)2
=> 4a + 4b + 2*0.05 = 0.18 + 9c
giải các hệ => x = 0.1 ; y = 0.01; z = 0.04
=> muối gồm nAl(NO3)3 = 0.1 ; nZn(NO3)2 = 0.01 ; nMg(NO3)2 = 0.05 ; nNH4NO3 = 0.04
m muối = 33.79
12.
Cho b mol Al tan hoàn toàn trong dung dịch chứa a mol NaOH thu được dung dịch X. Thêm dung dịch chứa d mol HCl vào X thu được c mol kết tủa. Giá trị lớn nhất của d được tính theo biểu thức:
A:
d = a + 3b + c
B:
d = a + 3b –3c
C:
d = a + 3b – c
D:
d = a + b – c
Đáp án: B
Sản phẩm sau tất cả phản ứng :
phần kết tủa c mol Al(OH)3;
phần dung dịch : a mol Na+ ; b - c mol Al3+ ; d mol Cl-
bảo toàn điện tích a + 3(b - c) = d <=> d = a + 3b - 3c
13.
Nung 24,5 gam KClO3 một thời gian thu được 4,032 lít O2(đkc) và hỗn hợp rắn X. Trong X, KCl chiếm 50,69% vềkhối lượng. Thành phần % của KClO3 trong X là:
A:
19,2%
B:
32,68%
C:
50,34%
D:
42,19%
Đáp án: B
nKClO3=0.2 ; nO2 = 0.18 ; mX = 24.5 - mO2 = 18.74
nKCl = 18.74*0.5069 / (39 + 35.5) = 0.1275
X có KCl ; KClO3 a mol ; KClO4 b mol
=> a + b = 0.2 - 0.1275 ;
bảo toàn O: 3a + 4b = 0.2*3 - 0.18*2
giải ra a = 0.05 => %m = 32.68%
14.
Điện phân dung dịch chứa 0,2 mol NaCl vàx mol Cu(NO3)2(điện cực trơ, màng ngăn xốp) sau một thời gian thu được dung dịch X vàkhối lượng dung dịch giảm 21,5 gam. Cho thanh sắt vào dung dịch X đến khi các phản ứng xảy ra hoàn toàn thấy khối lượng thanh sắt giảm 1,8 gam và thấy thoát ra khí NO duy nhất. Giá trị của x là:
A:
0,6
B:
0,5
C:
0,3
D:
0,4
Đáp án: B
Vì có khí NO nên Cl- điện phân hết gọi số mol H2O điện phân ở anot là 2a thì số mol H+ sinh ra là 4a, ta có
(0,1+2a)*64 + 0,2*35,5 + 32a = 21,5 => a =0,05mol => số mol H+ = 0,2mol
Nhúng thanh Fe nên Fe dư khi phản ứng với H+ và NO3 - lên Fe2+ vậy số mol Fe phản ứng là 0,2/8*3 =0,075mol
gọi số mol của Fe phản ứng với Cu là b(mol) ta có
0,075*56 - 8b = 1,8 => b=0,3
Vậy x = 0,3+(0,2+4a)/2 = 0,3 + 0,1 + 0,1 =0,5mol đáp án B
15.
Thực hiện phản ứng crackinh m gam isobutan, thu được hỗn hợp A gồm các hidrocacbon. Dẫn A qua bình đựng 250 ml dung dịch Br21M thấy bình đựng brom mất màu và thoát ra 11,2 lít (đktc) hỗn hợp khí B. Tỉ khối của B so với hiđro là 15,6. Giá trị của m là:
A:
21,75
B:
23,20
C:
29,00
D:
26,10
Đáp án: D
nBr2=0,25 = số mol anken phản ứng
nB=0,5
Gọi số mol isobutan ban đầu là a, số mol bị cracking là x như vậy trong B gồm C4H10 (a-x) mol; CH4 x mol; C3H6 (x-0,25) mol theo tỉ khối của B với Hiđro ta có: 58*(a-x) + 16*x +42(x-0,25) = 15,6 => 58*a=26,10 đáp án D
Nguồn: /

