Đề thi thử THPT Quốc Gia Lần 2 năm 2016 Trường THPT Chuyên KHTN - Hà Nội - Môn Hóa Học
Cập nhật: 13/07/2020
1.
Cho hỗn hợp Zn và Fe vào dung dịch CuSO4 , phản ứng xong thu được chất rắn X gồm 2 kim loại và dung dịch Y chứa 3 loại ion. Nhận xét nào sau đây đúng :
A:
Zn chưa phản ứng hết, Fe chưa phản ứng , CuSO4 đã phản ứng hết
B:
Zn phản ứng hết, Fe phản ứng hết , CuSO4 còn dư
C:
Zn phản ứng hết, Fe còn dư , CuSO4 đã phản ứng hết
D:
Zn phản ứng hết, Fe chưa phản ứng , CuSO4 đã phản ứng hết
Đáp án: C
Các phản ứng có thể xảy ra :
Zn + Cu2+ → Zn2+ + Cu
Fe + Cu2+ → Fe2+ + Cu
Chất rắn gồm 2 kim loại => đó phải là Fe và Cu => CuSO4 hết và Zn hết
Dung dịch có 3 ion => đó là Zn2+ ; SO42- và Fe2+ => Fe dư 1 phần
Đáp án đúng C
2.
Phân lớp electron ngoài cùng của nguyên tử X,Y lần lượt là 3sa ; 3pb. Biết phân lớp 3s của X và Y hơn kém nhau 1 electron và Y tạo được hợp chất khí với Hidro có công thức H2Y. Nhận định nào sau đây là đúng :
A:
X tan trong nước tạo dung dịch làm đỏ quì tím
B:
Y tan trong nước làm quì tím hóa xanh
C:
Liên kết X và Y thuộc loại liên kết cộng hóa trị
D:
Số electron độc thân trong nguyên tử Y gấp 2 lần trong nguyên tử X
Đáp án: D
Hợp chất của Y với H là H2Y => Y thuộc nhóm VIA ( 3s23p4) [ có 2e độc thân ]
Vì phân lớp 3s của X và Y hơn kém nhau 1e => X : 3s1 => X là kim loại kiềm (IA)
[ có 1 e độc thân ]
Đáp án đúng D
3.
Hòa tan hoàn toàn 1,62g Al trong 280 ml dung dịch HNO3 1M thu được dung dịch X và khí NO ( sản phẩm khử duy nhất). Cho 5,75g kim loại Na và 500 ml dung dịch HCl thu được dung dịch Y. Trộn dung dịch X với dung dịch Y tạo thành 1,56g kết tủa. Nồng độ mol của dung dịch HCl là :
A:
3M
B:
0,3M
C:
0,15M
D:
1,5M
Đáp án: B
nAl = 0,06 mol ; nHNO3 = 0,28 mol
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
=> nAl3+ = 0,06 mol ; nH+ dư = 0,04 mol
Khi trộn X vào Y thì thu được kết tủa chính là Al(OH)3 => nAl(OH)3 = 0,02 mol
+) TH1 : Al3+ dư => nNaOH = 3nAl3+ pứ + nH+ = 3nAl(OH)3 + nH+ = 0,1 mol < 0,25 = nNa
Xét dung dịch X ta có : nNaOH = nNa ban đầu – nHCl => nHCl = 0,15 mol
=> CM(HCl) = 0,3M ( Có đáp án thỏa mãn )
Đáp án đúng B
4.
Để phân biệt 3 loại dung dịch H2N-CH2-COOH , CH3COOH ; CH3CH2NH2 chỉ cần 1 thuốc thử là :
A:
Na kim loại
B:
dd NaOH
C:
Quì tím
D:
dd HCl
Đáp án: C
H2N-CH2-COOH : không làm quì tím đổi màu
CH3COOH : làm quì tím hóa đỏ
CH3CH2NH2 : làm quì tím hóa xanh
Đáp án đúng C
5.
Hỗn hợp X gồm 2 kim loại Y và Z đều thuộc nhóm IIA và ở 2 chu kỳ liên tiếp trong bảng tuần hoàn ( MY< MZ). Cho m gam hỗn hợp X vào nước dư thấy thoát ra V lit khí H2. Mặt khác , cho m gam hỗn hợp X vào dung dịch HCl dư , sau phản ứng hoàn toàn thấy thoát ra 3V lit khí H2 ( thể tích các khí đo ở cùng điều kiện ). Phần trăm khối lượng của Y trong hỗn hợp X là
A:
54,54%
B:
66,67%
C:
33,33%
D:
45,45%
Đáp án: A
m gam phản ứng với HCl tạo lượng khí lớn khi phản ứng với H2O
=> X có kim loại không phản ứng với H2O
Mà Y và Z thuộc hai chu kỳ liên tiếp => Y = Mg(24) và Z là Ca(40)
Do nCa = nH2 (1) = (V over 22,4)mol mà nMg = nH2(2) - nCa = 2(V over 22,4)
=> Hỗn hợp kim loại có tỉ lệ mol Mg : Ca là 2 :1
=> %my(x) = 54,54%
Đáp án đúng A
6.
Cho các phát biểu sau :
(1) Phenol tan vô hạn trong nước ở 660C
(2) Phenol có lực axit mạnh hơn ancol etylic
(3) Phản ứng thế vào benzen dễ hơn phản ứng thế vào nhân thơm của phenol
(4) Phenol tan tốt trong etanol
(5) Phenol làm quí tím hóa đỏ
(6) Phenol phản ứng được với Brom ở điều kiện thường
Có bao nhiêu phát biểu đúng :
A:
5
B:
4
C:
3
D:
6
Đáp án: B
(1) Phenol tan vô hạn trong nước ở 660C
Đúng
(2) Phenol có lực axit mạnh hơn ancol etylic
Đúng
(3) Phản ứng thế vào benzen dễ hơn phản ứng thế vào nhân thơm của phenol
Sai. Phản ứng thế vào benzen khó hơn
(4) Phenol tan tốt trong etanol
Đúng
(5) Phenol làm quí tím hóa đỏ
Sai. Phenol không làm đổi màu quì tím
(6) Phenol phản ứng được với Brom ở điều kiện thường
Đúng
Đáp án B đúng
7.
Phát biểu nào sau đây là đúng :
A:
Phèn chua được dùng là chất làm trong nước , khử trùng nước
B:
Phèn chua dùng trong ngành thuộc da và công nghiệp giấyDung dịch NaHCO3 có môi trường axit
C:
Dung dịch NaHCO3 có môi trường axit
D:
Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+
Đáp án: D
Phèn chua được dùng là chất làm trong nước , khử trùng nước
Sai. Phèn chua không có khả năng khử trùng nước
Phèn chua dùng trong ngành thuộc da và công nghiệp giấy
Sai. Phèn chua không được sử dụng trong công nghiệp giấy
Dung dịch NaHCO3 có môi trường axit
Sai. Dung dịch NaHCO3 có môi trường bazo
Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+
Đúng
Đáp án đúng D
8.
Cho các phản ứng :
(1) O3 + dd KI
(2) H2S + SO2
(3) KClO3 + HCl đặc ( đun nóng )
(4) NH4HCO3 (t0C)
(5) NH3 (khí) + CuO (t0)
(6) F2 + H2O (t0)
(7) H2S + nước clo
(8) HF + SiO2
(9) NH4Cl + NaNO2 (t0)
(10) C + H2O (t0)
Số trường hợp tạo ra đơn chất là :
A:
6
B:
8
C:
7
D:
5
Đáp án: C
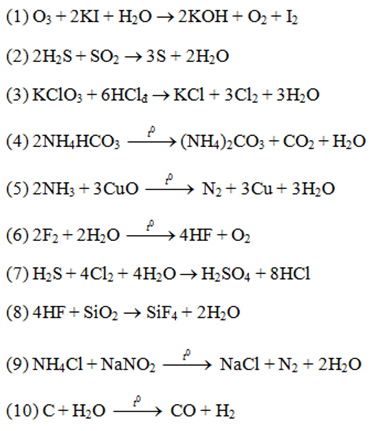
Đáp án đúng C
9.
Cho cân bằng hóa học N2 (khí) + 3H2(khí) → 2NH3(khí). Khi nhiệt độ tăng thì tỷ khối của hỗn hợp khí so với H2 giảm đi . Phát biểu đúng khi nói về cân bằng này là :
A:
Phản ứng nghịch tỏa nhiệt , cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ
B:
Phản ứng thuận tỏa nhiệt , cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ
C:
Phản ứng nghịch thu nhiệt , cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ
D:
Phản ứng thuận thu nhiệt , cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ
Đáp án: B
Do bảo toàn về khối lượng và số mol hỗn hợp khí vế trái lớn hơn vế phải
=> MTrái < Mphải
Theo đề khi t0 tăng thì d/H2 ↓ => M ↓ => cân bằng dịch chuyển theo chiều nghịch
=> phản ứng nghịch thu nhiệt => phản ứng thuận tỏa nhiệt.
Đáp án đúng B
10.
Để đánh giá lượng axit béo tự do trong chất béo người ta dùng chỉ số axit. Đó là số miligam KOH cần dùng để trung hòa lượng axit béo tự do có trong 1 gam chất béo . Để trung hòa 14g một chất béo cần 15 ml dung dịch KOH 0,1M. Chỉ số axit của chất béo đó là :
A:
5,6
B:
6,0
C:
7,0
D:
6,5
Đáp án: B
nKOH = 0,0015 mol => mKOH = 0,084g = 84 mg
=> Chỉ số axit = 6,0
Đáp án đúng B
11.
Phát biểu đúng là :
A:
Khi thủy phân chất béo luôn thu được C2H4(OH)2
B:
Tất cả các este khi phản ứng với dung dịch kiềm thì luôn thu được sản phẩm muối và ancol
C:
Phản ứng thủy phân este trong môi trường axit là phản ứng thuận nghịch
D:
Phản ứng giữa axit cacboxylic và ancol khí có H2SO4 đặc là phản ứng 1 chiều
Đáp án: C
Khi thủy phân chất béo luôn thu được C2H4(OH)2
Sai. Thủy phân chất béo luôn thu được C3H5(OH)3
Tất cả các este khi phản ứng với dung dịch kiềm thì luôn thu được sản phẩm muối và ancol
Sai. Có thể là ancol hoặc andehit hoặc xeton
Phản ứng thủy phân este trong môi trường axit là phản ứng thuận nghịch
Đúng
Phản ứng giữa axit cacboxylic và ancol khí có H2SO4 đặc là phản ứng 1 chiều
Sai. Là phản ứng thuận nghịch
Đáp án đúng C
12.
Cho m gam bột Fe vào 200 ml dung dịch gồm Pb(NO3)2 0,05M ; AgNO3 0,10M và Cu(NO3)2 0,1M , sau 1 thời gian thu được 3,84g hỗn hợp kim loại và dung dịch X . Cho 3,25g Zn vào dung dịch X , sau phản ứng xảy ra hoàn toàn , thu được 3,895g hỗn hợp kim loại và dung dịch Y. Giá trị của m là :
A:
1,428
B:
2,242
C:
2,856
D:
1,575
Đáp án: D
nZn = 0,05 mol
Lại có nNO3 = 2nPb + nAg + 2nCu = 0,08 mol < 2nZn
=> Y chỉ có Zn(NO3)2 : 0,04 mol
Bảo toàn khối lượng : mZn + mmuối X = mKL(2) + mmuối Y => mMuối Y = 8,205g
Bảo toàn khối lượng với : mFe + mmuối ban đầu = mKL(1) + mmuối X
=> mFe = m = 1,575g
Đáp án đúng D
13.
Dung dịch X thu được khi trộn một thể tích dung dịch H2SO4 0,1M với một thể tích dung dịch HCl 0,2M. Dung dịch Y chứa NaOH 0,2M và Ba(OH)2 0,1M. Đổ 100 ml dung dịch X vào 100 ml dung dịch Y , khuấy đều để phản ứng xảy ra hoàn toàn thu được 200 ml dung dịch X có pH = a và m gam kết tủa Y ( Coi H2SO4 điện ly hoàn toàn cả 2 nấc). Giá trị của a và m lần lượt là :
A:
13 và 1,165
B:
7 và 2,330
C:
1 và 2,330
D:
7 và 1,165
Đáp án: A
dd X : nH+ = 2nH2SO4 + nHCl = 0,02 mol
, dd Y : nOH = nNaOH + 2nBa(OH)2 = 0,04 mol
=> Trong Y : nOH – nH+ = 0,02 mol = nOH- => COH = 0,1M => pH = 13
Đáp án đúng A
14.
Cho các dung dịch sau : saccarozo ; propan-1,2-diol ; etylen glicol ; anbumin ; axit axetic ; glucozo ; andehit axetic ; Gly-Ala. Số dung dịch hòa tan Cu(OH)2 ở nhiệt độ thường là :
A:
4
B:
6
C:
5
D:
7
Đáp án: B
Số dung dịch thỏa mãn : Saccarozo ; Propan-1,2-diol ; etylen glicol ; anbumin ; axit axetic ; glucozo
Đáp án đúng B
15.
Phát biểu nào sau đây là đúng :
A:
Nitrophotka là hỗn hợp của NH4H2PO4 và KNO3
B:
Cacbon monoxit và silic dioxit là oxit axit
C:
Thủy tinh lỏng là dung dịch đậm đặc của Na2SiO3 và K2SiO3
D:
Photpho trắng có cấu trúc mạng tinh thể nguyên tử , photpho đỏ có cấu trúc polime
Đáp án: C
Nitrophotka là hỗn hợp của NH4H2PO4 và KNO3
Sai. Nitrophotka là hỗn hợp (NH4)2HPO4 và KNO3
Cacbon monoxit và silic dioxit là oxit axit
Sai. CO là oxit trung tính
Thủy tinh lỏng là dung dịch đậm đặc của Na2SiO3 và K2SiO3
Đúng
Photpho trắng có cấu trúc mạng tinh thể nguyên tử , photpho đỏ có cấu trúc polime
Sai. P trắng có cấu trúc mạng tinh thể phân tử
Đáp án đúng C
Nguồn: /

