Đề thi thử THPT quốc gia lần 2 năm 2016 trường THPT Hoàng Văn Thụ- Môn Hóa Học
Cập nhật: 13/07/2020
1.
2,7 gam một miếng nhôm để ngoài không khí một thời gian, thấy khối lượng tăng thêm 1,44 gam. Phần trăm miếng nhôm đã bị oxi hóa bởi oxi của không khí là:
A:
60%
B:
40%
C:
50%
D:
80%
Đáp án: A
2.
X là một kim loại. Hòa tan hết 3,24 gam X trong 100 ml dung dịch NaOH 1,5M, thu được 4,032 lít H2 (đktc) và dung dịch D. X là ?
A:
Zn
B:
Al
C:
Cr
D:
K
Đáp án: B
3.
Tách Ag ra khỏi hỗn hợp Fe, Cu, Ag thì dùng dung dịch nào sau đây?
A:
HCl
B:
NH3
C:
Fe(NO3)3
D:
HNO3 đậm đặc
Đáp án: C
4.
Hòa tan hoàn toàn 2,52 gam kim loại M trong dung dịch H2SO4 loãng tạo thành 6,84 gam muối sunfat. M là kim loại nào?
A:
Al
B:
Zn
C:
Mg
D:
Fe
Đáp án: D
5.
Hoà tan 7,8g hỗn hợp bột Al và Mg trong dung dịch HCl dư. Sau phản ứng khối lượng dung dịch axit tăng thêm 7,0g. Khối lượng nhôm và magie trong hỗn hợp đầu là:
A:
2,7g và 1,2g
B:
5,4g và 2,4g
C:
5,8g và 3,6g
D:
1,2g và 2,4g
Đáp án: B
Áp dụng định luật bảo toàn khối lượng ta có :mH2 = 7,8-7,0 =0,8 gam
Mặt khác theo công thức 1 và theo đề ta có hệ phương trình:
(Khi tham gia phản ứng nhôm nhường 3 e, magie nhường 2 e và H2 thu về 2 e)
3.nAl + 2.nMg =2.nH2=2.0.8/2 (1)
27.nAl +24.nMg =7,8 (2)
Giải phương trình (1), (2) ta có nAl =0.2 mol và nMg = 0.1 mol
Từ đó ta tính được mAl =27.0,2 =5,4 gam và mMg =24.0,1 =2,4 gam
6.
Cho 15,8 gam KMnO4 tác dụng với dung dịch HCl đậm đặc. Thể tích khí clo thu được ở điều kiện tiêu chuẩn là:
A:
5,6 lít.
B:
0,56 lít.
C:
0,28 lít.
D:
2,8 lít.
Đáp án: A
Theo công thức 1 ta có :Mn+7 nhường 5 e (Mn+2),Cl- thu 2.e áp dụng định luật bảo toàn e ta có :5.nKmnO4 =2.ncl2 từ đó suy ra số mol clo bằng 5/2 số mol KMnO4 =0.25 mol từ đó suy ra thể tích clo thu được ở đktc là:0,25 . 22,4 =0,56 lít
7.
Hòa tan 9,14g hợp kim Cu, Mg, Al bằng một lượng vừa đủ dung dịch HCl thu được 7,84 lít khí X (đktc) và 2,54g chất rắn Y và dung dịch Z. Cô cạn dung dịch Z thu được m(g) muối, m có giá trị là
A:
31,45g.
B:
33,25g.
C:
3,99g.
D:
35,58g.
Đáp án: A
8.
Hòa tan hết 7,74 gam hỗn hợp bột Mg, Al bằng 500ml dung dịch hỗn hợp HCl 1M và H2SO4 0,28M thu được dung dịch X và 8,736 lít khí H2 (đktc). Cô cạn dung dịch X thu được lượng muối khan là:
A:
25,95 g
B:
38,93 g
C:
103,85 g
D:
77,86 g
Đáp án: B
: Tổng số mol H+ là: 0,5.(1+2.0,28)=0,78 mol
Số mol H2 là: 8,736:22,4 = 0,39 mol
2H+ + 2e → H2
0,78 0,39
Þ Lượng H+ tham gia phản ứng vừa đủ.
Áp dụng công thức 2 tính khối lượng muối:
mmuối = m2 kim loại + 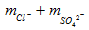
= 7,74 + 1.0,5.35,5 + 0,28.0,5.96 =38,3 g
9.
Khử hoàn toàn một oxit sắt nguyên chất bằng CO dư ở nhiệt độ cao. Kết thúc phản ứng, khối lượng chất rắn giảm đi 27,58%. Oxit sắt đã dùng là:
A:
Fe2O3
B:
Fe3O4
C:
FeO
D:
Cả 3 trường hợp (a), (b), (c) đều thỏa đề bài
Đáp án: B
10.
Chia hỗn hợp hai kim loại A, B có hóa trị không đổi thành hai phần bằng nhau. Phần 1 hòa tan hết trong dung dịch HCl, thu được 1,792 lít khí H2 (đktc). Phần 2 nung trong oxy thu được 2,84 gam hỗn hợp các oxit. Khối lượng hỗn hợp hai kim loại trong hỗn hợp đầu là:
A:
1,56 gam
B:
1,8 gam
C:
2,2 gam
D:
3,12 gam
Đáp án: D
11.
Hòa tan hết 2,925 gam kim loại M trong dung dịch HBr dư, sau phản ứng thu được 1,008 lít (đktc). Xác định kim loại M.
A:
Fe
B:
Zn
C:
Al
D:
Mg
Đáp án: B
Áp dụng công thức 1: nH2 = hóa trị . nkim loại
=> 2 . 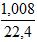 =
= 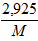 . n (n là hóa trị của kim loại M)
. n (n là hóa trị của kim loại M)
=> M = 32,5.n
Chọn n = 2, M = 65
12.
Cho m gam hỗn hợp Mg và Al vào 250 ml dung dịch X chứa hỗn hợp acid HCl 1M và H2SO4 0,5M thu được 5,32 lít H2 (đktc) và dung dịch Y (xem thể tích dung dịch là không đổi). Dung dịch Y có pH là:
A:
1
B:
2
C:
7
D:
6
Đáp án: A
Để tính pH cần tính số mol H+ còn lại sau phản ứng.
Tổng số mol H+ trươc phản ứng là: 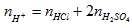
=0,25.1 + 2.0,5.0,25 =0,5 mol
Quá trình khử H+ tạo H2: 2H+ + 2e → H2
0,475 mol 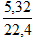 mol
mol
Þ số mol H+ đã phản ứng là: 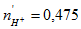 mol
mol
Số mol H+ còn lại là: 0,5 – 0,475 = 0,025 mol
Nông độ H+ trong dung dịch Y là: [H+]=0,025/0,25=0,1 M
Þ pH=-lg[H+]=-lg0,1=1.
13.
Hòa tan 7,84 gam Fe vào 200 ml dung dịch hỗn hợp hai acid HCl 0,15M và H2SO4 0,25M thấy thoát ra V lít khí H2 (đktc). Giá trị của V là:
A:
1,456 lít
B:
0,45 lít
C:
0,75 lít
D:
0,55 lít
Đáp án: A
14.
Cho hỗn hợp gồm Ba, Al2O3 và Mg vào dung dịch NaOH dư, có bao nhiêu phản ứng dạng phân tử có thể xảy ra?
A:
1
B:
2
C:
3
D:
4
Đáp án: C
15.
Cho dung dịch NaOH lượng dư vào 100 ml dung dịch FeCl2 có nồng C (mol/l), thu được một kết tủa. Đem nung kết tủa này trong chân không cho đến khối lượng không đổi, thu được một chất rắn, Đem hòa tan hết lượng chất rắn này bằng dung dịch HNO3 loãng, có 112cm3 khí NO (duy nhất) thoát ra (đktc). Các phản ứng xảy ra hoàn toàn. Trị số của C là:
A:
0,10
B:
0,15
C:
0,20
D:
0,05
Đáp án: B
Nguồn: /

