Đồng
Cập nhật: 30/06/2020
Vị trí và cấu tạo :
+) Vị trí của đồng trong bảng tuần hoàn
Đồng là nguyên tố kim loại chuyển tiếp, thuộc nhóm IB, chu kỳ 4, có số hiệu nguyên tử là 29.
+) Cấu tạo của đồng
- Cấu hình electron
Trong các hợp chất, đồng có số oxi hóa phổ biến là +1 và +2. Cấu hình electron của các ion đồng là: Cu+, [Ar]3d10 ; Cu2+,[Ar]3d9.
- Cấu tạo của đơn chất
Bán kính nguyên tử Cu:0,128(nm)
Bán kính các ion Cu+ và Cu2+ : 0,095 và 0,076(nm)
Độ âm điện: 1,9
Năng lượng ion hóa I1 ,I2 : 744 ; 1956(kJ/mol)
Thế điện cực chuẩn (E^0_{Cu^{2+} /Cu} ) : +0,34(V)
Tính chất vật lí :
Đồng là kim loại màu đỏ, dẻo, dễ kéo sợi và dát mỏng (có thể dát mỏng đến 0,0025mm, mỏng hơn giấy viết 5−6 lần). Đồng có độ dẫn điện và dẫn nhiệt rất cao (chỉ kém bạc). Độ dẫn điện của đồng giảm nhanh nếu có lẫn tạp chất. Do vậy dây dẫn điện là đồng có độ tinh khiết tới 99,99%. Khối lượng riêng của đồng là 8,98g/cm3; Nhiệt độ nóng chảy 10830C.
Tính chất hóa học :
Trong dãy điện hóa, đồng có thế điện cực chuẩn (E^0_{Cu^{2+} /Cu} ) = +0,34V, đứng sau cặp oxi hóa - khử 2H+/H2. Đồng là kim loại kém hoạt động, có tính khử yếu. Tính chất này được chứng minh qua những phản ứng hóa học sau.
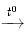 2CuO
2CuO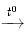 Cu2O
Cu2OĐồng có thể tác dụng với Cl2,Br2,S,... ở nhiệt độ thường hoặc đun nóng:
Cu + S 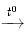 CuS
CuS
+) Tác dụng với axit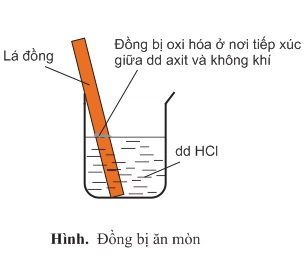
Đồng không tác dụng với dung dịch HCl, H2SO4 loãng. Tuy vậy, với sự có mặt của oxi trong không khí, Cu bị oxi hóa thành muối Cu(II).
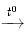 CuSO4 + SO2↑ + 2H2O
CuSO4 + SO2↑ + 2H2OĐồng khử được ion của những kim loại đứng sau nó trong dãy điện hóa ở trong dung dịch muối:
Những ứng dụng của đồng chủ yếu dựa vào tính dẻo, tính dẫn điện, tính bền và khả năng tạo ra nhiều hợp kim. Hợp kim đồng có nhiều ứng dụng trong công nghiệp và đời sống là:
- Đồng thau là hợp kim Cu − Zn(45%Zn ) có tính cứng và bền hơn đồng, dùng chế tạo các chi tiết máy, chế tạo các thiết bị dùng trong công nghiệp đóng tàu biển.
- Đồng bạc là hợp kim Cu−Ni(25%Ni), có tính bền, đẹp, không bị ăn mòn trong nước biển. Đồng bạch được dùng trong công nghiệp tàu thủy, đúc tiền,...
- Đồng thanh là hợp kim Cu−Sn, dùng để chế tạo máy móc, thiết bị.
- Hợp kim Cu − Au, trong đó 2/3 là Cu,1/3 là Au (hợp kim này được gọi là vàng 9 cara), dùng để đúc các đồng tiền vàng, vật trang trí,...
Các ngành kinh tế sử dụng đồng trên thế giới:
- Công nghiệp điện: 58%
- Kiến trúc, xây dựng: 19%
- Máy móc công nghiệp: 17%
- Các ngành khác: 6%
Nguồn: /

