Nike
Cập nhật: 06/07/2020
Niken là nguyên tố kim loại chuyển tiếp, thuộc nhóm VIIIB, chu kì 4, có số hiệu nguyên tử là 28 trong bảng tuần hoàn. Trong các hợp chất, niken có số oxi hóa phổ biến là +2, ngoài ra còn số oxi hóa là +3.
Cấu hình electron nguyên tử Ni : [Ar]3d84s2
Niken có tính khử yếu hơn sắt ((E^0_{Ni^{2+} /Ni}) = −0,26V )
Niken có thể tác dụng được với nhiều đơn chất và hợp chất: khi đun nóng có thể phản ứng với một số phi kim như oxi, clo,...; phản ứng được với một số dung dịch axit, đặc biệt là tan dễ dàng trong dung dịch axit HNO3 đặc nóng.
Ví dụ:
 2NiO
2NiO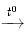 NiCl2
NiCl2Ở nhiệt độ thường, Ni bền với không khí, nước và một số dung dịch axit do trên bề mặt niken có một lớp màng oxit bảo vệ.
+) Ứng dụng
Phần lớn Niken được dùng để chế tạo hợp kim, Ni có tác dụng làm tăng độ bền, chống ăn mòn và chịu nhiệt độ cao.
Ví dụ:
- Hợp kim Inva Ni−Fe không giãn nở theo nhiệt độ, được dùng trong kĩ thuật vô tuyến,...
- Hợp kim đồng bạch Cu−Ni có tính bền vững cao, không bị ăn mòn dù trong môi trường nước biển, dùng để chế tạo chân vịt tàu biển, tuabin cho động cơ máy bay phản lực.
Một phần nhỏ niken được dùng:
- Mạ lên các kim loại khác để chống ăn mòn.
- làm chất xúc tác (bột Ni) trong nhiều phản ứng hóa học.
- Chế tạo ăcquy Cd−Ni (có hiệu điện thế 1,4V), ăcquy Fe−Ni.
Nguồn: /

